2.6.2粒径及分布测定
取优选工艺制备的克班宁脂质体于纳米粒度仪中进行测定,结果如图1-7所示,粒度分布图接近正态分布。平均粒径为133.13nm,分散指数:PI=0.3777,PI=Dw/Dn(PI为多分散指数, 即重均分子量与数均分子量之比。一般用来衡量体系的分子量分布;其中Dw、Dn分别为重均、数均粒子直径,其中前者表示高分子轮廓长度的多分散性后者表示高分子直径的多分散性)。说明克班宁脂质体粒度分布较均匀,达到预期粒度要求。
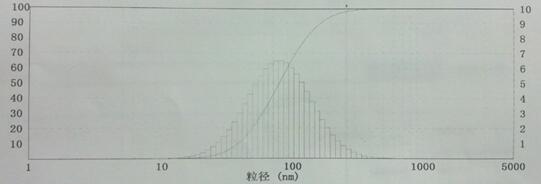
图7 克班宁脂质体粒度分布图
2.6.3稳定性初步试验
将最佳方案制备的克班宁脂质体于4℃冰箱中密封放置1、3天、5天、10天、15天、20天、30天后分别精密吸取3ml上柱洗脱,按上述方法测定其吸光度并计算包封率[7],含量分别为81.81%、80.05%、72.44%、70.46%、61.33%、60.02%、51.07%。说明按优选方案制备的脂质体,随着时间推移,药物泄漏较明显,存在一个明显的释药过程,稳定性下降。
3.讨论
3.1 葡聚糖凝胶层析法测定包封率的过程中,首先选择柱的径高比0.9/10,上样1mL,收集过程中发现流速很慢仅有0.5ml/min,吸光度范围小,由于流速缓慢,再加上进样量小,导致测定误差较大且需较长时间测定包封率,故不采用径高比0.9/10;更换柱的径高比为2/13,上样量为3ml,流速控制为1ml/min进行洗脱,将收集的洗脱液加入2ml无水乙醇破乳,再用PBS溶液定容至10ml测定吸光度,绘制洗脱曲线,则可以得到很好的分离,说明柱子应选择合适的高度和内径,控制洗脱速度及上样量,否则脂质体洗脱效果不佳。
3.2 在考察克班宁脂质体的稳定性初步考察中,在显微镜观察中出现的少量棒状形态,或有聚集现象,据文献报道[8],这可能和卵磷脂易水解和分散介质PBS的加入有关,分散介质PBS的加入对脂质体的分散状态有显著影响;且变形和聚集现象随着PBS浓度的增加而显著增多;而且随着时间的推移,卵磷脂水解氧化克班宁脂质体,降低膜的流动性,药物的包封率逐渐降低,加剧药物的泄漏,且溶液的pH值、表面电荷、氧化因素、粒径、组成、所载药物的物理和化学特性,以及外界温度等都是影响脂质体稳定性的因素[9],说明脂质体不稳定,目前可用于改良稳定性的方法有可以(a)用饱和磷脂代替不饱和磷脂(b)在水相中加入表面活性剂,p-188,t-80,胆酸钠等一些表面活性剂提高zeta电位或者加入一定量的多糖化合物来增加脂质体的稳定性[8];(e)采用冷冻干燥法制备脂质体;制备长循环脂质体、免疫脂质体、前体脂质体等新型脂质体均能改善脂质体稳定性。[9]提高脂质体的稳定性还有待于进一步研究。
参考文献:
[1]马云淑,方波,张壮丽.云南含克班宁的千金藤属植物资源调查研究[J]云南中医学院学报,2005,(01)
[2]姚新武,脂质体的制备及应用研究[D].北京化工大学,2012.
[3]赵润英,王玮,赵丽妮.紫杉醇长循环前体脂质体的制备及其性质[J].中国医院药学 杂志,2009,29(5):414-416
[4]夏书芹,范明辉,许时婴,等.红景天苷前体脂质体的制备与性质研究[J].食品科学,2009,30(6):35-40.
[5]王汀,李文秀,邓英杰.微柱离心-药脂比测定脂质体药物包封率[J].沈阳药科大学学 报,2008,25(1):10-14.
[6]范云鹏,王德云,胡元亮,等.正交试验优选黄芪多糖脂质体的制备工艺[J].中草药,2011,42(3):470-473.
[7]郭丹,熊阳,孙鹏.Nobiliside-A脂质体包封率测定方法的研究[J].中成药,2009,31(2):208-212.
[8]于丽娜.分散介质对脂质体粒径、形态、分散状态的影响[J].药物研究,2007.6(1)
[9]武博达.影响脂质体稳定性的主要因素及对策[J].兽药与饲料添加剂,2000.12(5)



