2.3 鼠膝关节软骨细胞凋亡情况
结果显示益气养血方药物干预抑制KOA模型大鼠软骨细胞凋亡,差异有显著性意义,见图3。
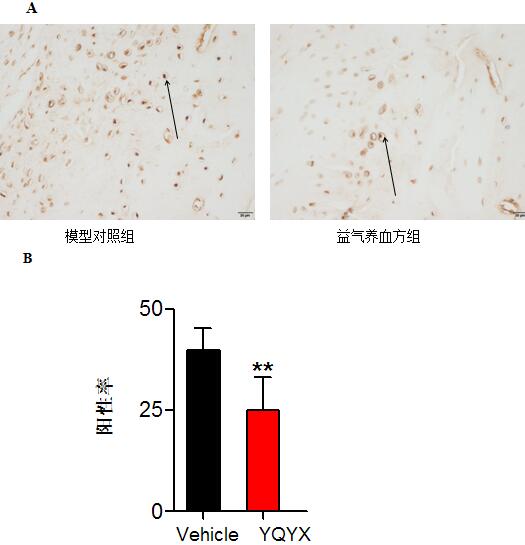
图3 益气养血方对KOA模型大鼠软骨细胞凋亡的水平的影响(Tunel染色,400×)。益气养血方对KOA模型大鼠软骨细胞凋亡情况(A)。统计阳性率(B)
β-catenin、WISP-1、BMP-2、BMP-4、MMP-1、MMP-13 mRNA的表达
3 讨论
膝骨关节炎(KOA)是累及骨、软骨下骨、滑膜、韧带、周围肌肉和关节囊的慢性骨关节病,近年研究认为其与肥胖、骨内压、细胞因子学说、自由基学说、NO作用、基质金属蛋白酶降解学说、血管病理变化、免疫等因素有关[ ][ ],但其具体病因尚不明确。为探索膝骨关节炎的发病及药物对KOA的影响机制研究,我们利用改良Hulth法进行SD大鼠KOA模型的建立,模拟了KOA病理变化[ ],以便进行药物干预机制研究。
Wnt/β-catenin能影响软骨细胞功能调控,是骨关节炎病因及药物机制的研究热点[ ][ ][ ]。研究表明,经典的Wnt信号通路常常通过调节细胞内β-catenin水平,改变β-catenin亚细胞定位被激活[ ]。在Wnt没有被激活的情况下,β-catenin水平保持稳定状态,β-catenin会被GSK-3β、Axin1、Axin2、APC、Dvl、CK1以磷酸化的方式被降解[ ]。当Wnt信号被激活以后,Wnt与 Fizzled、LRP5/6受体结合并活化,导致β-catenin进入细胞核内,β-catenin与TCF/LEF转录因子结合,激活下游靶基因的表达[ ]。其中WISP-1是Wnt/β-catenin靶基因之一,能参与关节软骨下骨的发育[ ];而通过对OA患者的关节软骨、滑膜等组织的基因检测,Wnt7b与OA发生最为密切[ ];而当BMP2、BMP4表达下降时,β-catenin的表达也收到抑制[ ];BMP-2能促进骨关节的生长,维持骨关节成熟,而过量表达的BMP-2也对骨关节生长有抑制作用[ ]。众多研究表明Wnt/β-catenin,信号通路在OA中有重要作用,通过Wnt/β-catenin,进行OA机制研究及药物研发,是治疗OA的重要思路。
吴生元教授在临床中根据“补后天以养先天”,以“补益气血,调补肝肾”为治疗方针指导治疗骨关节炎,取得较好临床疗效。据此治疗原则在经方基础上加减组合而成益气养血方。前期研究表明,益气养血方临床安全性高,依从性好,能明显改善患者症状及关节功能[ ] 。并且,益气养血方能下调兔KOA血清TNF-α、MMP-13水平,上调COL-II表达从而保护软骨基质[1];同时能够下调大鼠Wnt4水平,上调WIF1水平抑制关节软骨病变[2]。中药治疗KOA是一个多系统多靶点的过程,我们着眼于Wnt/β-catenin,采用现代分子生物学技术,探讨益气养血方部分作用机制。本研究提示,益气养血方通过下调β-catenin、WISP-1、BMP-2、BMP-4的蛋白表达,干预大鼠软骨细胞凋亡以保护关节软骨,抑制软骨退变。
参考文献
[1 ]李兆福,万春平,赵杯沛,等.益气养血方对兔膝OA模型软骨细胞凋亡及炎症因子表达的影响[A].全国第十届中西医结合风湿病学术会议论文汇编[C]2012,20-64.
[ 2]李翠葳,郑喜,李兆福,等.益气养血方对膝骨关节炎模型大鼠血清Wnt4和WIF1的影响[J].风湿病与关节炎.2017,6(6):5-10.
[3 ]何俊君,吴子健,洪振强.骨性关节炎致病因素的研究进展[J].中国中医药现代远程教育.2017,15(10):149-152.
[4 ]袁普卫,杨威,康武林,等.骨性关节炎发病机制研究进展[J].中国骨质疏松杂志,2016(7):902-906.
[5 ]肖春苟,锦慧,力强,等.以改良Hulth法建立兔膝骨性关节炎关节软骨的病理变化[J].中国中医骨伤科杂志,2014,22(12):1-3.
[6 ] Rockel JS, Yu C, Whetstone H, et al. Hedgehog inhibits β‐catenin activity in synovial joint development and osteoarthritis[J]. J Clin Invest,2016,126(5):1649-1663.
[7 ] Bouaziz W, Sigaux J, Modrowski D, et al. Interaction of HIF1α and β‐catenin inhibits matrix metalloproteinase 13 expression and prevents cartilage damage in mice s[J].Proc Natl Acad Sci USA, 2016, 113(19):5453-5458.
[8 ] Chen L, Wu Y, Wu Y, et al. The inhibition of EZH2 ameliorates osteoarthritis development through the Wnt/β‐catenin pathway[J].Sci Rep,2016,6:29176.
[9 ] Yachuan Zhou, Tingyu Wang, John L;et al. Wnt/β-catenin Signaling in Osteoarthritis and in Other Forms of Arthritis[J]. Curr Rheumatol Rep,2017,19(53):54-61.
[10 ] Behrens J, Jerchow BA, Wurtele M, et al. Functional interaction of an axin homolog conductin with β-catenin, APC, and GSK3β [J]. Science. 1998;280:596–9.
[11 ] Staal FJ, Clevers H. Tcf/Lef transcription factors during T-cell development:unique and overlapping functions[J]. Hematol J. 2000;1:3–6.
[12 ] Nakamura Y, NawataM,Wakitani S. Expression profiles and functional analyses of Wnt-related genes in human joint disorders[J]. AmJ Pathol. 2005;167(1):97–105.
[13 ] Javier Fernández-Torres, Cristina Hernández-Díaz, Rolando Espinosa-Morales; et al. Polymorphic variation of hypoxia inducible factor-1 A (HIF1A) gene might contribute to the development of knee osteoarthritis: a pilot study[J]. Fernández-Torres et al. BMC Musculoskeletal Disorders,2015,16(218):1-7.
[14 ] Chen M, Zhu M, awad H, et al. Inhibition of beta-catenin signaling causes defects in postnatal cartilage development[J].J Cell Sci, 2008. 121: 1455-1465.
[15 ] Laura W, Gamer, Steven Pregizer;et al. The role of Bmp2 in the maturation and maintenance of the murine knee joint[R].Boston Department of Developmental Biology, Harvard School of Dental Medicine,2018:1-35.
[16 ]李兆福,彭江云,肖长虹,等.骨痹(骨关节炎)诊疗方临床验证总结[J].风湿病与关节炎.2012,1(1):16-21.



