黄宽1,范源1,2*(1.云南中医药大学,云南省 昆明市 650500;2.云南中医药大学第二附属医院,云南省 昆明市 650216)
余甘子为大戟科叶下珠属植物余甘子Phyllanthus emblica L的干燥成熟果实,是藏族习用药材。其性味甘、酸、涩、凉;归肺、胃经;具有清热凉血,消食健胃,生津止渴的功效;常用于治疗血热血瘀、咳嗽、喉痛、口干、消化不良、腹胀等[1]。余甘子中富含多酚鞣质类、黄酮类、有机酸、维生素、氨基酸等活性成分[2],以多酚类鞣质含量最多[3],具有抗菌[4,5]、抗炎[6]、抗病毒[7]、抗肿瘤[8,9,10]、抗氧化[11,12,13,14,15]、降血糖[16,17]等药理作用,研究发现没食子酸和其酯类衍生物可作为一种有价值的抗癌药物[18,19]。没食子酸(Gallica acid,GA)、焦性没食子酸(Pyrogallic acid,PA)、1,3,6-O-三没食子酰基葡萄糖(1,3,6-tri-O-galloyl-β-D-glucose,TGG)、1,2,3,4,6-五-O-没食子酰基葡萄糖(1,2,3,4,6-penta-O-galloyl-β-D-glucose,β-PGG)属天然水解类鞣质,没食子鞣质极不稳定,容易在酸、碱、酶的催化作用下水解,生成没食子酸和多元醇。GA为弱酸性物质,在高温或催化条件下还原脱羧后可生成焦性没食子酸。β-PGG在酸、碱条件下发生水解,逐步生成四没食子酰葡萄糖、TGG、二没食子酰葡萄糖、葡萄糖和没食子酸[20]。余甘子作为药食两用的传统习用民族药物,营养丰富,药效明确,目前其加工利用主要有果汁、果肉制成的饮料、果脯、果酒、果酱,其种子和提取物也常作为食品或添加剂使用[21]。但余甘子在我国的开发利用还相对较低,使其有效物质活性高,且不出现褐变,溶剂PH值尤为关键。本研究以提高余甘子质量标准为目的,以获得有效控制余甘子质量的方法。
图1 化学结构
1 仪器与试剂
Agilent 1200高效液相色谱仪(美国Agilent公司),色谱柱为 Agilent Zorbax C18键合硅胶柱(150 mm×4.6 mm,5 µm);语路超声波清洗机(深圳市即洁超声科技有限公司);DFY-600摇摆式高速万能粉碎机(永康式速锋工贸有限公司);T-1000型电子天平(上海浦春计量仪器有限公司);AB265-SMETTLER TOLEDO十万分之一分析天平(Mettler-tolido international trade(Shanghai) co.LTD)。
对照品:焦性没食子酸(PA批号:TS0905CA14,上海源叶生物科技有限公司)、没食子酸(GA批号:wkq16081904,四川省维克奇生物科技有限公司)、1,3,6-O-三没食子酰基葡萄糖(TGG批号:CFN95043,武汉天植生物技术有限公司)、1,2,3,4,6-O-五没食子酰葡萄糖(β-PGG批号:PRF10011001,成都普瑞法科技开发有限公司);余甘子(批号:P20180612,安国市旭芳中药材经营有限公司)。甲醇、乙腈为色谱纯,其余试剂为分析纯,水为超纯水。
2 方法与结果
2.1 色谱条件
色谱柱为Zorbax C18(4.6 mm×250 mm,5 μm);流动相:甲醇(A)-0.1%磷酸(B),梯度洗脱(0 ~ 2 min,2% ~ 5% A;3 ~10 min,5% ~ 10% A;10 ~ 26 min,10% ~ 15% A;26 ~ 45 min,15% ~ 26% A;45 ~ 75 min,26% ~ 35% A);流速:1.0 mL·min-1;检测波长:280 nm;柱温:25℃;进样量:10 μL。理论塔板数按焦性没食子酸计算应不低于3000。色谱图见图2。
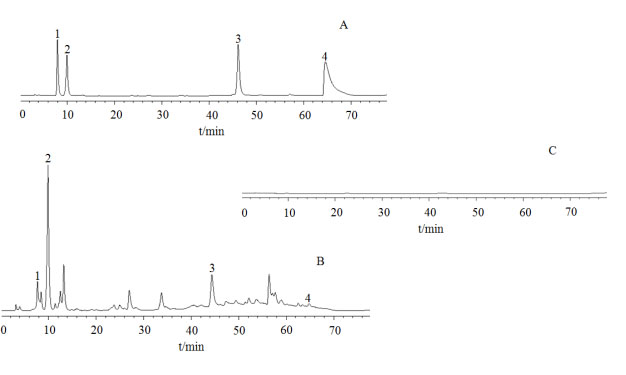
图2 高效液相色谱图
A 对照品溶液; B 供试品溶液; C 空白样品溶液; 1. PA; 2. GA; 3. TGG; 4. β-PGG
2.2 溶液的制备
2.2.1 磷酸缓冲液 A液:10 mL磷酸溶液,加水定容至100 mL;B液:7.2g磷酸氢二钠加水定容至100 mL。分别取上述不同体积的A液和B液混合配制成不同pH(2、3、4、5、6、7)的磷酸盐缓冲溶液,即得。
2.2.2 混合对照品溶液 分别精密称取各对照品适量,加甲醇定容。配制各对照品质量浓度分别为焦性没食子酸0.229 mg·mL-1、没食子酸0.148 mg·mL-1、1,3,6-O-三没食子酰基葡萄糖0.018 mg·mL-1、1,2,3,4,6-O-五没食子酰葡萄糖0.031 mg·mL-1。
2.2.3 供试品溶液 精密称取干燥的余甘子粉末2 g,精密加30mL的70%甲醇,超声60 min,冷却后用甲醇补足减失质量,过滤,滤液浓缩后用甲醇定容至25 mL,备用。用移液枪分别移取1mL置于6个样品瓶中,再分别加入1mLpH为2,3,4,5,6,7,8的磷酸缓冲液,摇匀静置,即得不同pH条件下的供试品溶液。
2.2.4 空白样品溶液 因最终定容时所用的溶剂为甲醇,故本研究中以甲醇作为空白溶液。
2.3 线性关系考察 配制不同质量浓度的对照品溶液,在“2.1”项条件下依次连续进样,以质量浓度(mg·mL-1)为横坐标(X),峰面积(mAU*s)为纵坐标(Y)进行线性回归,绘制标准曲线,结果见表1,表明各成分均具有良好的线性关系。
表1 线性关系考察结果
| 成分 | 回归方程 | r | 线性范围/(mg·mL-1) |
| PA | Y=3357.2X+84.156 | r=0.9996 | 0.0229~0.2290 |
| GA | Y=19235X+68.557 | r=0.9991 | 0.0148~0.1480 |
| TGG | Y=71454X-25.157 | r=0.9998 | 0.0018~0.0180 |
| β-PGG | Y=15222X+29.159 | r=0.9993 | 0.0031~0.0310 |
2.4 精密度试验 精密吸取“2.2.2”项下混合对照品溶液,在“2.1”项条件下连续进样6次,结果显示PA、GA、TGG、β-PGG峰面积RSD分别为0.72%、0.92%、1.15%、1.30%,表明仪器精密度良好。
2.5 稳定性试验 取同一份供试品溶液,在“2.1”项条件下,分别于2、4、6、8、10、12 h进样,结果显示PA、GA、TGG、β-PGG 10 h内峰面积的RSD值分别为1.21%、1.24%、1.11%、1.65%,表明供试品溶液在12 h内稳定性良好。
2.6 重复性试验 取同一批余甘子粉末6份,按“2.2.3”项下方法制备供试品溶液,在“2.1”项条件下进样,结果显示PA、GA、TGG、β-PGG含有量RSD分别为1.71%、1.15%、1.77%、1.56%,表明该方法重复性良好。
2.7 加样回收率试验 精密称取已知含量的同一批余甘子样品粉末9份,每份精密称取2 g,分别按照药材含有量的80%、100%、120%加入混合对照品,按“2.2.3”项下方法制备供试溶液,在“2.1”项条件下进样。结果见表2。
表2 加样回收率试验 (n=9)
| 成分 | 样品含量/mg | 加入量/mg | 测得量/mg | 回收率/% | 平均回收率/% | RSD/% |
| 1.3861 | 1.1100 | 2.4842 | 98.93 | |||
| 1.3861 | 1.1100 | 2.5238 | 102.50 | |||
| 1.3861 | 1.1100 | 2.5027 | 100.60 | |||
| 1.3861 | 1.3900 | 2.7456 | 97.81 | |||
| PA | 1.3861 | 1.3900 | 2.7558 | 98.54 | 100.27 | 1.70 |
| 1.3861 | 1.3900 | 2.7942 | 101.30 | |||
| 1.3861 | 1.6600 | 2.9897 | 99.66 | |||
| 1.3861 | 1.6600 | 3.0438 | 99.86 | |||
| 1.3861 | 1.6600 | 3.0992 | 103.20 | |||
| 2.695 | 2.1500 | 4.842 | 99.86 | |||
| 2.695 | 2.1500 | 4.815 | 98.60 | |||
| 2.695 | 2.1500 | 4.907 | 102.88 | |||
| 2.695 | 2.6900 | 5.396 | 100.41 | |||
| GA | 2.695 | 2.6900 | 5.365 | 99.26 | 99.89 | 1.40 |
| 2.695 | 2.6900 | 5.409 | 100.89 | |||
| 2.695 | 3.2300 | 5.848 | 97.62 | |||
| 2.695 | 3.2300 | 5.907 | 99.44 | |||
| 2.695 | 3.2300 | 5.928 | 100.09 | |||
| 0.1664 | 0.1330 | 0.3031 | 102.78 | |||
| 0.1664 | 0.1330 | 0.2978 | 98.85 | |||
| 0.1664 | 0.1330 | 0.3 | 101.35 | |||
| 0.1664 | 0.1660 | 0.3364 | 102.41 | |||
| TGG | 0.1664 | 0.1660 | 0.3314 | 99.42 | 100.67 | 1.71 |
| 0.1664 | 0.1660 | 0.3339 | 100.90 | |||
| 0.1664 | 0.1980 | 0.3701 | 102.88 | |||
| 0.1664 | 0.1980 | 0.3635 | 99.55 | |||
| 0.1664 | 0.1980 | 0.3602 | 97.89 | |||
| 0.1884 | 0.1520 | 0.3408 | 100.26 | |||
| 0.1884 | 0.1520 | 0.3396 | 99.45 | |||
| 0.1884 | 0.1520 | 0.3373 | 97.97 | |||
| 0.1884 | 0.1880 | 0.3834 | 103.72 | |||
| β-PGG | 0.1884 | 0.1880 | 0.3769 | 100.27 | 100.25 | 1.74 |
| 0.1884 | 0.1880 | 0.3756 | 99.56 | |||
| 0.1884 | 0.2260 | 0.4138 | 99.73 | |||
| 0.1884 | 0.2260 | 0.4205 | 102.70 | |||
| 0.1884 | 0.2260 | 0.4112 | 98.57 |
2.8 含量测定 取3份不同批次余甘子样品,按“2.2.2”项下方法制备供试品溶液,在“2.1”项下条件下进样,计算四种成分含有量,结果见表3。
表3 含量测定结果
| 批次 | PA/mg·g-1 | GA/mg·g-1 | TGG/mg·g-1 | β-PGG/mg·g-1 |
| P20180612 | 0.6513 | 1.3590 | 0.0864 | 0.0892 |
| P20180120 | 0.6904 | 1.3514 | 0.0840 | 0.0934 |
| P20181119 | 0.6718 | 1.3482 | 0.0852 | 0.0924 |
2.9 不同pH条件下含量变化 在缓冲液pH值为2~5的区间,随着pH的增大,PA含量呈逐渐减少的趋势;pH值为5~6的区间,随着pH的增大,PA含量呈逐渐增加的趋势;pH值为6~8的区间,随着pH的增大,PA含量逐渐减少,且当p H值为2时,在所测pH值范围中含量达到最高。在缓冲液pH值为2~5的区间,随着pH的增大,GA含量逐渐增加;pH值为5~6的区间,随着pH的增大,GA含量急剧减少;pH值为6~8的区间,随着pH的增大,GA含量逐渐下降,且当pH值为5时,在所测pH值范围中含量达到最高。在缓冲液pH值为2~4的区间,随着pH的增大,TGG含量逐渐增加;pH值为4~8的区间,随着pH的增大,TGG含量逐渐减少;且当pH值为4时,在所测pH值范围中含量达到最高。在缓冲液pH值为2~3的区间,随着pH的增大,β-PGG含量逐渐增加;pH值为3~5的区间,随着pH的增大,PGG含量逐渐减少;pH值为5~8的区间,随着pH的增大,PGG含量缓慢增加随后逐渐减少,且当pH值为3时,在所测pH值范围中含量达到最高。结果见表4和图2。
表4 不同pH条件下余甘子中GA、PA、TGG、β-PGG的含量变化
| PH值 | PA含量/mg·g-1 | GA含量/mg·g-1 | TGG含量/mg·g-1 | β-PGG含量/mg·g-1 |
| 2 | 0.5330 | 0.3898 | 0.0496 | 0.0364 |
| 3 | 0.2649 | 0.5499 | 0.0603 | 0.0417 |
| 4 | 0.1398 | 0.6750 | 0.0841 | 0.0276 |
| 5 | 0.0862 | 0.9401 | 0.0561 | 0.0226 |
| 6 | 0.1681 | 0.3901 | 0.0468 | 0.0253 |
| 7 | 0.0817 | 0.3391 | 0.0201 | 0.0148 |
| 8 | 0.0609 | 0.1486 | 0.0094 | 0.0052 |
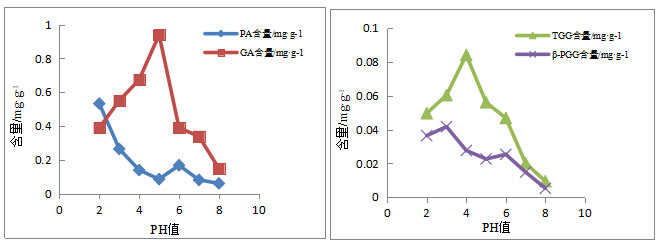
图3. 不同PH条件下余甘子中4种成分含量变化
3 讨论
中国云南省是主要的余甘子野生资源分布区[22],余甘子作为一种多民族习用药材,具有广泛的药学应用价值。根据多酚类化合物的化学性质,本实验测定余甘子中PA、GA、TGG和β-PGG的含量。目前尚无关于余甘子中TGG测定的报道,四种成分的测定可以为丰富与完善余甘子的质控体系提供参考。同时研究在不同pH条件下余甘子中PA、GA、TGG及β-PGG的含量变化,结果表明在pH2~8之间,PA含量随pH的增大而减小,原因可能是PA在碱性条件下分解,随着pH升高,其分解增加,在pH为6时,可能是因为GA分解产生的PA,PA含量稍有增加;GA含量随pH的增大而减少,在pH为5是含量最高,可能是由于β-PGG在酸性条件下水解,随着pH升高,GA含量减少;TGG含量随着pH增大含量增加,原因可能是β-PGG分解导致的含量增加,在pH为4时含量达到最高;β-PGG含量随着pH的增大而减小,可能是β-PGG自身水解解的原因。
余甘子作为主产于云南的常用藏方三果汤其中的一味,具有潜在而大的价值。本实验对不同pH条件下毛诃子中PA、GA、TGG及β-PGG含量变化进行了研究,可为余甘子中相关成分的质控、提取加工以及养护提供一定理论参考。
参考文献
[1] 国家药典委员会. 中华人民共和国药典 (一部) [M]. 北京: 中国医药科技出版社, 2015: 179.
[2] 朱华伟, 李伟, 陈运娇, 等. 余甘子化学成分及其抗炎作用的研究进展[J]. 中成药, 2018, 40(03): 670-674.
[3] Variya B C, Bakrania A K, Patel S S, et al. Emblica officinalis (Amla): A review for its phytochemistry, ethnomedicinal uses and medicinal potentials with respect to molecular mechanisms.[J]. Pharmacological Research, 2016: 180-200.
[4] Dinesh M, Roopan S M, Selvaraj C I, et al. Phyllanthus emblica seed extract mediated synthesis of PdNPs against antibacterial, heamolytic and cytotoxic studies[J]. Journal of Photochemistry and Photobiology B-biology, 2017: 64-71.
[5] 曹莉莉, 王芳, 杨贺忠, 等. 余甘子果实水溶性多糖抑菌及群体感应抑制活性初探[J]. 亚热带植物科学, 2015, 44(04): 289-292.
[6] 李伟, 朱华伟, 陈运娇, 等. 余甘子不同溶剂提取物抗炎活性的研究[J]. 天然产物研究与开发, 2018, 30(03): 418-424+443.
[7] Yadav S P, Singh M K, Singh P K, et al. Traditional knowledge to clinical trials: A review on therapeutic actions of Emblica officinalis[J]. Biomedicine & Pharmacotherapy, 2017: 1292-1302.
[8] Wang C, Yuan J, Wang C, et al. Anti-inflammatory Effects of Phyllanthus emblica L on Benzopyrene-Induced Precancerous Lung Lesion by Regulating the IL-1β/miR-101/Lin28B Signaling Pathway[J]. Integrative Cancer Therapies, 2017, 16(4): 505-515.
[9] Zhao T, Sun Q, Marques M, et al. Anticancer Properties of Phyllanthus emblica (Indian Gooseberry)[J]. Oxidative Medicine and Cellular Longevity, 2015: 950890-950890.
[10]陈静, 冯光远, 李登科, 等. 藏药余甘子鞣质部位对人肿瘤细胞凋亡与周期的影响[J]. 中国药物警戒, 2016, 13(04): 193-196.
[11] Poltanov E A, Shikov A N, Dorman H J, et al. Chemical and Antioxidant Evaluation of Indian Gooseberry (Emblica officinalis Gaertn., syn. Phyllanthus emblica L.) Supplements[J]. Phytotherapy Research, 2009, 23(9): 1309-1315.
[12] Pientaweeratch S, Panapisal V, Tansirikongkol A, et al. Antioxidant, anti-collagenase and anti-elastase activities of Phyllanthus emblica, Manilkara zapota and silymarin: an in vitro comparative study for anti-aging applications[J]. Pharmaceutical Biology, 2016, 54(9): 1865-1872.
[13] Li Y, Sun H, Yu X, et al. Evaluation of cellular antioxidant and antiproliferative activities of five main phyllanthus emblica L. cultivars in China[J]. Indian Journal of Pharmaceutical Sciences, 2015, 77(3): 274-282.
[14] 杨冰鑫, 刘晓丽. 余甘子总多酚的提取及其抗氧化活性研究[J]. 食品工业科技, 2019, 40(16): 151-155+162.
[15] Li Y, Chen J, Cao L, et al. Characterization of a novel polysaccharide isolated from Phyllanthus emblica L. and analysis of its antioxidant activities[J]. Journal of Food Science and Technology-mysore, 2018, 55(7): 2758-2764.
[16] 王锐. 余甘子多酚α-葡萄糖苷酶抑制及抗氧化作用[J]. 食品研究与开发, 2017, 38(11): 13-16.
[17] 王锐. 余甘子多糖体外降血糖及抗氧化活性研究[J]. 食品研究与开发, 2018, 39(17): 189-192+224.
[18] Locatelli C, Filippin-Monteiro FB, Creczynski-Pasa TB. Alkyl esters of gallic acid as anticancer agents: A review[J]. European Journal of Medicinal Chemistry, 2013, 60: 233–239.
[19] Choubey S, Varughese LR, Kumar V, et al. Medicinal importance of gallic acid and its ester derivatives: A patent review. Pharm Pat Anal, 2015, 4(4): 305–315.
[20] Krook M A, Hagerman A E. Stability of polyphenols epigallocatechin gallate and pentagalloyl glucose in a simulated digestive system[J]. Food Research International, 2012, 49(1): 112.
[21] 陈晓丹, 张俊仪, 林伟斌, 等. 余甘子提取物HPLC特征图谱研究[J]. 广东药科大学学报, 2018, 34(03): 282-287.
[22] 雷虓, 瞿文林, 金杰, 等. 国内余甘子种质资源研究现状[J]. 热带农业科学, 2018, 38(09): 40-44.



