
图6 信号通路富集分析柱状图
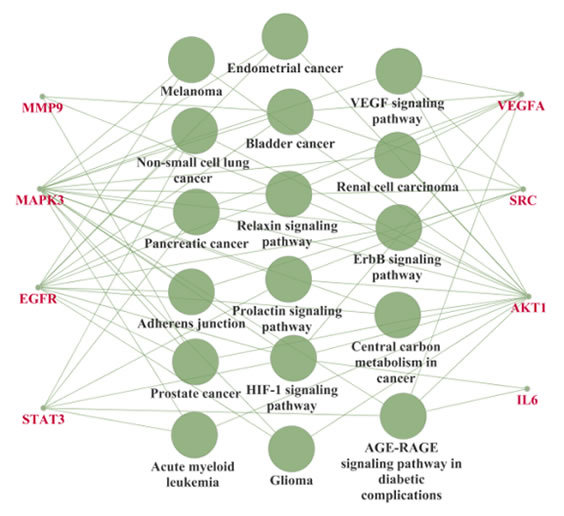
图7 核心靶点-代谢通路网络图
3讨论
本研究基于网络药理学平台,初步探讨了三七-莪术药对的主要活性成分、作用于肺纤维化的潜在核心靶点及其相关的生物信号通路。通过检索多个数据库和平台,应用Cytoscape 3.7. 1等软件和工具,筛选出三七-莪术药对的主要活性成分11个,作用于肺纤维化的核心靶点8个,代谢通路17条。
本研究结果显示,这8个核心靶点可能是三七-莪术药对缓解肺纤维化的关键作用靶点,值得进一步分析和验证。其中丝氨酸苏氨酸蛋白激酶(Akt1)参加了17条代谢通路中除了膀胱癌和黏着连接途径的其余15条代谢通路,是这15条通路中的关键基因,高度参与肺纤维化的发病过程。有研究表明,Akt1介导的巨噬细胞线粒体自噬与细胞凋亡抗性有关,而这促进了肺纤维化的发生发展[6],这可能Akt1与肺纤维化的关联途径之一,因此,我们推测三七-莪术药对可能通过下调Akt1的表达,达到抗肺纤维化的作用。血管内皮生长因子(VEGF)能通过促进内皮细胞增殖和肺泡毛细血管增生以及增加血管通透性,使纤维蛋白原外渗,促进细胞外基质沉积,进而加快肺纤维化的进程[7]。体外实验证明人参皂苷Rh2通过下调VEGF的表达进而抑制VEGF诱导的血管生成作用[8],同时,本研究发现VEGF也是人参皂苷F2的作用靶点之一,因此,我们认为人参皂苷F2也可能作用于VEGF并经血管内皮生长因子信号通路发挥抗纤维化的作用。白介素-6(IL-6)能够促进胶原纤维的沉积,同时抑制细胞外基质的分解以及促进成纤维细胞增殖,在纤维结缔组织和平滑肌增生过程中发挥重要的作用[9]。三七-莪术药对可能通过抑制IL-6的表达进而减轻肺部炎症反应和过度修复,达到缓解肺纤维化的作用。基质金属蛋白酶-9(MMP9)参与巨噬细胞诱导的成纤维细胞迁移而促进肺纤维化[10]。MMP9作为核心靶点,也可能是三七-莪术药对发挥疗效的关键靶点之一。有研究表明原癌基因酪氨酸蛋白激酶Src(SRC)的活化可以诱导强烈的促纤维化的级联信号传导[11],而使用Src激酶抑制剂可显著降低了α-平滑肌肌动蛋白(α-SMA)表达,这是肌成纤维细胞分化的标志物[12],其参与的ErbB信号通路、血管内皮生长因子信号通路、黏着连接、催乳素信号通路、松弛素信号通路、膀胱癌等信号通路可能是三七-莪术主要活性成分作用于肺纤维化的靶点途径。STAT3 是位于细胞质中的一种转录因子,许多细胞因子如IL⁃6等可将其磷酸化,活化后的STAT3向胞核聚集从而发挥调节细胞代谢、迁移、增殖及分化等多种生物学功能[13]。将STAT3 敲除或使用STAT3 活性抑制剂均能有效抑制肺泡上皮发生上皮⁃间质转变(EMT)和肺成纤维细胞的迁移,进而缓解肺纤维化[14],可见STAT3是肺纤维化进程中的关键因子。丝裂原活化蛋白激酶(MAPK)通路活化也可能是肺纤维化的发病机制之一[15]。肺纤维化的发生还可能与表皮生长因子受体(EGFR)高表达有关[16],而EGFR激活后可通过HIF-1信号通路进一步发挥生物学效应[17],本研究发现三七活性成分槲皮素、甘草素、人参皂苷Rh2和莪术活性成分双脱甲氧基姜黄素、wenjine均可能通过作用于表皮生长因子受体及HIF-1信号通路发挥抗肺纤维化作用。综上所述,本研究获得的多个核心靶点和代谢通路可作为三七-莪术药对作用于肺纤维化的机制以作进一步深入研究。
总之,本研究采用网络药理学的方法对三七–莪术药对缓解肺纤维化的复杂作用机制进行了探究,充分体现了中药复方多活性成分、多作用靶点、多代谢通路的特点,为进一步的实验验证提供基础,同时也为探讨研究中药复方发挥疗效的物质基础和作用机制提供新思路。
参考文献:
[1]曹孟淑, 蔡后荣, 代华平. 2015ATS/ERS/JRS/ALAT官方的临床实践指南:特发性肺纤维化的治疗(执行摘要)——对2011年临床指南的更新[J]. 中国呼吸与危重监护杂志, 2016(2):189-197.
[2]李超, 王玲. 特发性肺纤维化患者中医证型及疾病预后研究进展[J]. 新疆中医药, 2019, 37(01):124-126.
[3]高宁, 李天聪, 程玉鹏, 等. 龙胆裂环环烯醚萜类有效成分作用机理的网络药理学研究[J]. 化学工程师, 2017(1):14.
[4]Li J, Zhao P, Li Y, et al. Systems pharmacology-based dissection of mechanisms of Chinese medicinal formula Bufei Yishen as an effective treatment for chronic obstructive pulmonary disease [J]. Sci Rep, 2015, doi:10.1038/srep1529.
[5]骆帝, 许波, 李刚, 等. 骨碎补治疗骨关节炎的网络药理学研究[J]. 中草药, 2018,49 (15):3516-3522.
[6]Jennifer L. Larson-Casey, Jessy S. Deshane, Alan J. Ryan, et al. Macrophage Akt1 Kinase-Mediated Mitophagy Modulates Apoptosis Resistance and Pulmonary Fibrosis[J]. Immunity, 2016, 44(3):582-596.
[7]樊丽超, 姜莉. 血管内皮生长因子和内皮抑素在肺纤维化中的作用[J]. 国际呼吸杂志, 2011, 31 (14): 1090一1093.
[8]Zhang X P , Li K R , Yu Q , et al. Ginsenoside Rh2 inhibits vascular endothelial growth factor–induced corneal neovascularization[J]. Faseb Journal Official Publication of the Federation of American Societies for Experimental Biology, 2018:fj201701074RR.
[9]Le T T T, Karmoutyquintana H, Melicoff E, et al. Blockade of IL-6 Trans Signaling Attenuates Pulmonary Fibrosis[J]. Journal of Immunology Author Choice, 2014, 193(7):3755.
[10]Li G , Jin F , Du J , et al. Macrophage-secreted TSLP and MMP9 promote bleomycin-induced pulmonary fibrosis[J]. Toxicology and Applied Pharmacology, 2019.
[11]Wermuth P J, Jimenez S A. Abrogation of transforming growth factor-β-induced tissue fibrosis in TBRIcaCol1a2Cre transgenic mice by the second generation tyrosine kinase inhibitor SKI-606 (Bosutinib).[J]. PLoS ONE, 2018, 13(5).
[12]Hu M , Che P , Han X , et al. Therapeutic Targeting of Src Kinase in Myofibroblast Differentiation and Pulmonary Fibrosis[J]. Journal of Pharmacology and Experimental Therapeutics, 2014, 351(1):87-95.
[13]罗丽珊, 董航明, 黄超文, 等. 1,25(OH)_2D_3通过抑制STAT3活化改善博来霉素诱导的小鼠肺纤维化[J]. 实用医学杂志, 2017(01):67-71.
[14]Pedroza M, Le T T, Lewis K, et al. STAT-3 contributes to pulmonary fibrosis through epithelial injury and fibroblast-myofibroblast differentiation[J]. Faseb Journal Official Publication of the Federation of American Societies for Experimental Biology, 2015, 30(1):129.
[15]Das D , Holmes A , Murphy G A , et al. TGF-beta1-Induced MAPK activation promotes collagen synthesis, nodule formation, redox stress and cellular senescence in porcine aortic valve interstitial cells.[J]. Journal of Heart Valve Disease, 2013, 22(5):621-630.
[16]李龙, 杨兰生, 李慧, 等. EGFR/STAT信号通路相关蛋白在特发性肺纤维化中的表达及临床意义[J]. 西安交通大学学报(医学版), 2013(4):7-11.
[17]Xiao Li, Jiaywei Tsauo, Chong Geng, et al. Ginsenoside Rg3 Decreases NHE1 Expression via Inhibiting EGF-EGFR-ERK1/2-HIF-1α Pathway in Hepatocellular Carcinoma: A Novel Antitumor Mechanism[J]. The American Journal of Chinese Medicine, 2019.



