李晨曦,秦国政*
(云南中医药大学,云南 昆明 650500)
慢性前列腺炎(Chronic Prostatitis, CP)是泌尿外科的常见疾病,临床表现为会阴、小腹等部位胀痛,尿道灼热,尿道滴白,部分患者还伴有性功能障碍或精神紧张、焦虑等症状。具有病程长,病情顽固,反复发作,迁延难愈等特点。CP主要发生于20至50岁的男性[1],全球约有10~14%的男性会受到影响,多达50%的男性在一生中的某个时候会受到其影响[2-3]。CP常见并发症包括性功能障碍和焦虑[4-5],据调查显示,CP患者早泄和勃起功能障碍的发生率分别约为45.3%和47.4%[6],对男性同胞的身心健康和生活质量造成了极大的影响,如何有效防治CP成为当前男科领域关注的热点。
中医将CP归属于“精浊”“白淫”等范畴。《素问・玉机真藏论》曰:“少腹冤热而痛,出白”,即指小腹胀痛不适,从小便滴出乳白色的混浊液体,因病位在精室,故称“精浊”。秦国政教授认为本病与肝、肾、膀胱等脏腑功能失常有关,病位主要在精室,治疗上基于疮疡理论[7],将“消、托、补”三法有机结合应用于CP治疗的全过程。秦氏四妙散是云南省名中医秦国政教授临床治疗CP的经验方,全方由黄芪、玄参、金银花、甘草四味药物组成,对湿热内蕴的患者有较好的疗效。本研究采用网络药理学系统地预测秦氏四妙散治疗CP的活性成分、潜在靶点、信号通路,利用分子对接法初步模拟成分与靶点的结合,并结合体内实验进行初步验证,为后续深入研究提供参考依据。
1 材料与方法
1.1 筛选秦氏四妙散的有效成分及成分靶点
采用TCMSP数据库(http://tcmspw.com/tcmsp.php)进行检索,检索词为“黄芪”“金银花”“玄参”“甘草”。设置口服生物利用度(OB)>30%、类药性(DL)>0.18对ADME参数进行限定,获取秦氏四妙散的有效化学成分。同时,依据UniProt数据库中的人类基因数据库对秦氏四妙散有效活性成分的对应的靶点进行注释。
1.2 收集CP的相关靶点
运用Genecards、DisGeNET和OMIM数据库检索CP的相关靶点,参照MeSH主题词表,以“Chronic Prostatitis”为主题词进行检索,将三个数据库检索到的结果汇总后查重,即获得前列腺炎的相关靶点。
1.3 筛选共同靶点并构建蛋白相互作用网络( PPI)
通过Venny2.1软件,对秦氏四妙散的有效活性成分靶点和前列腺炎靶点进行映射,筛选出共同靶点,同时绘制韦恩图。运用STRING数据库,在“Multiple proteins”检索框检索共同靶点,靶点分数默认为>0.41,不显示游离靶点,导出蛋白互作网络图和tsv文件,并运用Cytoscape3.8.2软件对其进行网络进行拓扑学分析,明确网络中的关键靶点并做可视化分析。
1.4 GO功能与KEGG通路富集分析
运用“clusterProfiler”软件包,通过R软件进行共有靶点的GO功能和KEGG通路富集分析,并绘制条形图和气泡图,对结果进行可视化。
1.5 中药秦氏四妙散制备的方法
秦氏四妙散由黄芪(30 g)、金银花(10 g)、玄参(30 g)、甘草(10 g)组成(均购自云南省中医医院),每剂总量为80克。根据《中药药理实验方法学》,加入5~8倍量的中药饮片,浸泡1~2小时,煮沸30分钟后过滤。残渣用水稀释3~6倍,然后再煮15~20分钟,然后过滤。合并两次煎液,并进一步煎制成提取物。制备后,在4℃下储存,直至使用。人体日治疗剂量(80 g)作为中剂量,SMS-L(四妙散低剂量组)、SMS-M (四妙散中剂量组)、SMS-H(四妙散高剂量组)大鼠给药剂量分别为4g/kg/d,8g/kg/d、16g/kg/d。
1.6主要试剂和仪器
COX-2大鼠ELISA试剂盒:酶联,ml058808;IL-1β大鼠ELISA试剂盒:酶联,ml037361;IL-6大鼠ELISA试剂盒:酶联,ml102828;PGE2大鼠ELISA试剂盒:酶联,ml003036;TNF-α大鼠ELISA试剂盒:酶联,ml002859;酶标仪:美国Molecular公司 SPECTCA MAX190。
1.7动物模型和治疗
将30只体重为250±20g的健康雄性Wistar大鼠随机分为5组,每组6只:假手术组、模型组、四妙散低剂量组、中剂量组和高剂量组。根据张琳等人的方法建立CP大鼠模型[8]。模型复制成功后,四妙散高、中、低剂量组分别用进行灌胃,模型组和假手术组用等量生理盐水灌胃;灌胃28天后,用乙醚麻醉,迅速取出前列腺组织,处死大鼠。所有涉及实验动物的程序均经过云南中医药大学动物伦理委员会的评估和批准。
1.8生化分析和组织病理学检查
前列腺组织样本浸泡在多聚甲醛固定液中,根据脱水、透明和浸蜡的标准程序,将固定的1cm前列腺组织石蜡包埋。然后将其切成5微米厚的组织块用于HE染色。并在在高倍显微镜(200×)下观察间质内淋巴细胞和中性粒细胞浸润,腺泡形状是否规则、水肿、腺腔扩张,间质增宽,有纤维细胞增生、血管增生等病理变化。
切割适量前列腺组织标本后,加入一定量的PBS。用液氮迅速冷冻保存备用。标本融化后仍然保持2~8℃的温度。加入一定量的PBS(PH7.4),用手工或匀浆器将标本匀浆充分。离心20分钟左右(3000转/分)。仔细收集上清。分装后一份待检测,其余冷冻备用。以3000转/分钟的速度离心10分钟,并在-20℃下储存,直到进一步分析。用酶联免疫吸附法测定前列腺组织中IL-6、IL-1β、TNF-α、COX-2、PGE2的浓度。
1.9统计分析
结果为平均标准偏差和组间差异,通过单因素方差分析和图基检验进行分析。所有数据均使用GraphPad Prism 8.0软件进行分析,P值< 0.05被视为具有统计学意义。
2 结果
2.1 网络药理学结果
2.2 靶标预测 运用TCMSP数据库获得秦氏四妙散的有效成分共144个,对应3221个基因。运用UniProt数据库对中药有效成分的靶点基因进行注释并查重后,获得1761个靶点基因。运用Genecards、DisGeNET和OMIM数据库检索CP的相关靶点并查重,即获得CP的相关靶点8735个。通过Venny2.1软件,对秦氏四妙散的有效活性成分靶点和CP靶点进行映射,结果筛选出188个共同靶点,绘制韦恩图,如图1。
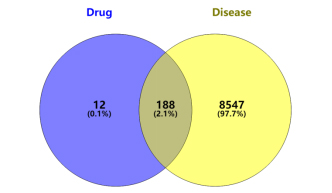
图1 秦氏四妙散与CP交集基因Venn图
2.3 PPI网络的构建分析 将秦氏四妙散与CP的共有靶点导入String数据库,得到秦氏四妙散与CP的蛋白相互作用网络,如图2。图中共有188个靶点,3997条边。节点之间的连线表示两者之间存在相互作用,颜色不同则相互作用类型不同,连线越多则作用越密切。通过barplot可以更直观地看出各节点所连接节点数,越多则该节点在网络中的作用越关键,如图3。依据连接节点数进行排序,排名前10的蛋白依次为AKT1、IL6、TP53、MAPK3、VEGFA、JUN、TNF、EGF、CASP3、MAPK1。这进一步说明这些关键蛋白是该网络的核心,掌控着整个网络的重要节点。提示以上靶点为PPI网络的核心,在整个网络中具有重要作用。
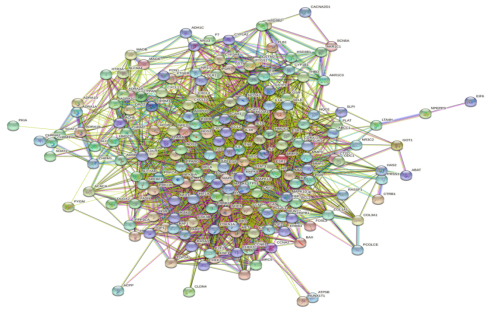
图2 秦氏四妙散与CP蛋白相互作用网络图
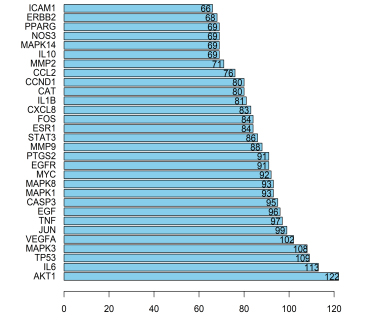
图3 秦氏四妙散与CP barplot图
2.4 药物-有效成分-核心靶点-疾病的网络构建 运用Cytoscape3.8.2软件构建药物-有效成分-核心靶点-疾病关系网络,如图4。188个药物-疾病共有核心靶点与144个秦氏四妙散有效成分相互关联,共计2000条边。依据Degree值进行排序,Degree值前5的有效成分为:槲皮素、山柰酚、芒柄花素、异鼠李素、毛蕊异黄酮。这从网络药理学的角度提示秦氏四妙散中不同药物对CP的治疗具有成分、靶点多样的特点。

图4 药物-有效成分-核心靶点-疾病的网络图
注:QSSMS代表秦氏四妙散,PC代表CP;砖红色长方形代表CP的靶标基因;绿色代表秦氏四妙散有效活性成分。
2.5 GO功能富集分析 运用R语言对药物与疾病的61个共同基因进行GO分析,依据校正P值进行排序,值筛选出排名前20的通路,靶标基因主要富集在这20条通路上,如图5。其中,主要涉及nuclear receptor activity、ligand-activated transcription factor activity、DNA-binding transcription factor binding、RNA polymerase II-specific DNA-binding transcription factor binding、cytokine receptor binding等生物学过程,体现了秦氏四妙散治疗CP是通过调控多种生物学过程共同作用的结果。
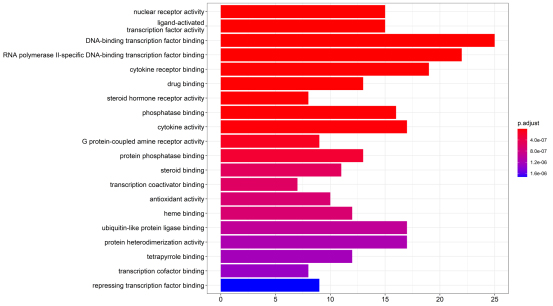
图5 秦氏四妙散治疗CP潜在靶点的GO功能富集分析图
2.6 KEGG通路富集分析 为了揭示秦氏四妙散对CP的治疗作用机制,运用软件对筛选出的188个共同靶点进行KEGG富集分析,筛选出校正P值小于0.05的通路共175条,并依据校正P值进行排序,显示校正P值最低的前20条通路进行绘图,包IL-17 signaling pathway、Prostate cancer、Bladder cancer、TNF signaling pathway、Endocrine resistance等涉及调控炎症反应、细胞凋亡、内分泌及前列腺癌、膀胱癌等的信号通路,如图6。提示了秦氏四妙散可通过多条通路对CP发挥治疗作用,同时对前列腺癌可能还有一定的抑制作用。
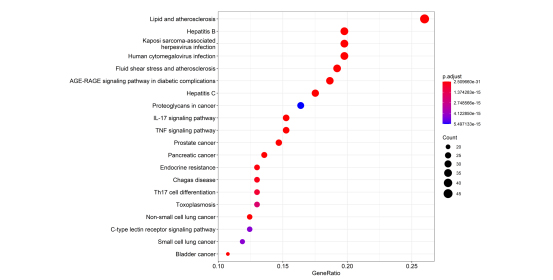
图6 秦氏四妙散治疗CP潜在靶点的KEGG功能富集分析图
2.7分子对接结果 利用AutoDockVina软件,将药物-有效成分-核心靶点-疾病网络图中Degree值排名前五的药物有限成分分别与5个核心靶蛋白进行分子对接,对接次数默认为9次,结果见表1。一般认为结合能<-5.0kcal/mol,表明靶蛋白与活性成分结合性好,且结合能越小表明两者对接越好。表中84%的对接分值小于-5.0kcal/mol,表明这5种成分与靶点结合性能总体较好,能在一定程度上验证成分-靶点之间的结合活性。其中isorhamnetin与PGE2结合性最好,如图--,从图中可看出isorhamnetin与PGE2相互作用,结合后呈现稳定状态。
表1 关键成分与相应靶点分子对接结果
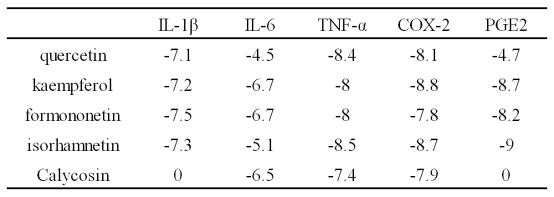
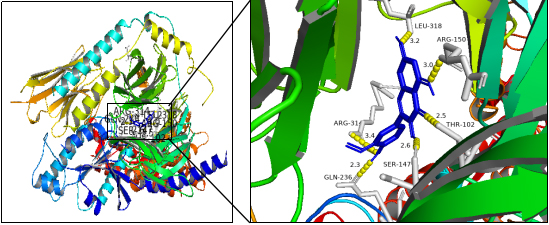
图7 isorhamnetin与PGE2分子对接图
2.8 秦氏四妙散对大鼠CP模型HE病理的影响(200×)
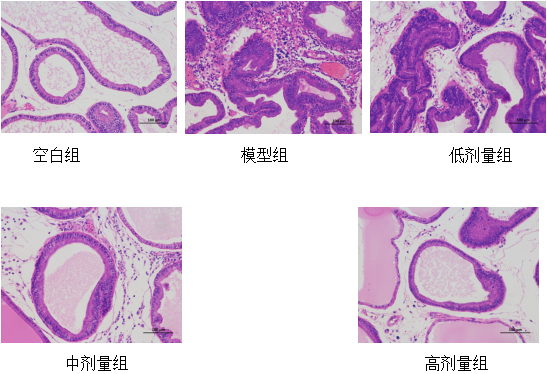
图8 大鼠前列腺组织病理切片。HE染色(10×20)观察大鼠前列腺组织炎症浸润和纤维增生情况。
与空白对照组相比,模型组大鼠前列腺组织表现为腺泡形状不规则和水肿,间质内淋巴细胞和中性粒细胞明显浸润,间质增宽,有纤维细胞增生和血管增生;与模型组相比,中药低剂量组前列腺组织腺腔结构基本完整,间质间隙减小,腺腔及间隙炎性细胞浸润减少,纤维细胞增生和血管增生减轻;中药中剂量组前列腺组织腺腔结构较为完整,间质间隙减小,腺腔及间隙炎性细胞浸润较少,纤维细胞增生和血管增生减轻;中药高剂量组前列腺组织腺腔结构完整,间质间隙减小,腺腔及间隙炎性细胞浸润极少,纤维细胞增生和血管增生明显减轻。
2.9 秦氏四妙散对大鼠CP模型炎症因子的影响
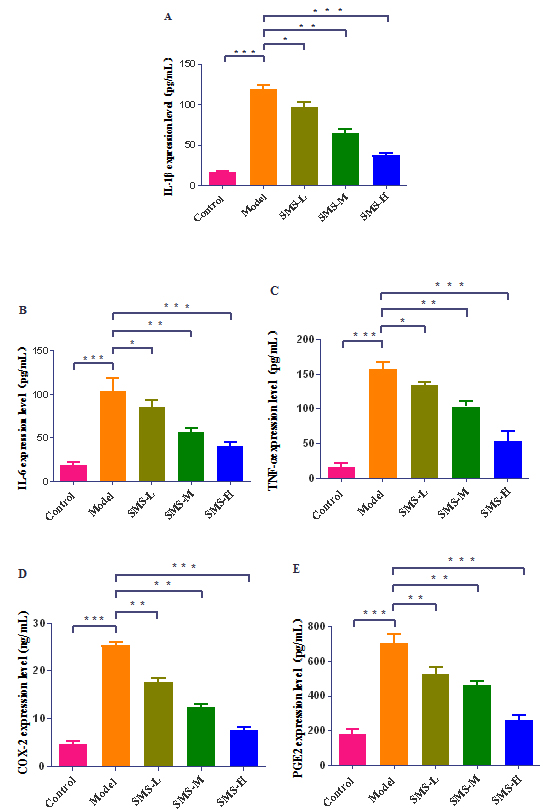
图9 ELIS检测IL-6、IL-1β、TNF-α、COX-2、PGE2表达水平。所有数据均表示为平均标准偏差(SD) (n=6)。* p<0.05,** p<0.01,*** p<0.001。
3 讨论
本研究基于网络药理学平台,初步探讨秦氏四妙散的主要活性成分、作用于CP的潜在核心靶点及其相关的生物信号通路。通过网络数据库筛选,最终获得144个活性成分和1761个药物靶点。药物靶点与疾病靶点匹配后得到188个交集靶点,通过构建PPI网络筛选出排名前10的蛋白依次为AKT1、IL6、TP53、MAPK3、VEGFA、JUN、TNF等。运用Cytoscape3.8.2软件构建药物-有效成分-核心靶点-疾病关系网络,依据Degree值进行排序,秦氏四妙散中排名前5的有效成分为:槲皮素、山柰酚、芒柄花素、异鼠李素、毛蕊异黄酮,提示秦氏四妙散中不同药物对CP的治疗具有成分、靶点多样的特点。
槲皮素是一种天然的生物类黄酮化合物,有良好的抗炎和抗氧化作用[9]。槲皮素能有效改善氧化应激引起的细胞损伤,降低COX-2因子的转录表达,进而炎症损伤水平下调[10]。有研究显示,槲皮素能明显降低CP患者NIH-CPSI的疼痛评分和生活质量评分,槲皮素治疗后CP患者前列腺按摩液中PGE2和前列腺素F2水平下降[11]。山奈酚属于黄酮类化合物,具有抗氧化和抗炎活性.可以通过抑制P53、TGF-β1和COX-2的表达,减少细胞凋亡[12]。有研究显示,芒柄花素通过调控MAPK信号转导通路和NF-κB通路,促进人前列腺腺癌细胞凋亡[13]。异鼠李素能明显减轻干眼模型小鼠的眼表损伤和白细胞介素-1(IL)-1β、IL-8和肿瘤坏死因子-α的表达[14]。毛蕊异黄酮通过抑制NF-κB信号通路发挥抗炎、抗氧化、调节免疫和体内激素水平等作用[15-16]。秦氏四妙散可能基于以上成分作用于IL6、MAPK3、JUN、TNF、CASP3、MAPK1等靶点发挥治疗CP的作用,分子对接也验证了以上筛选的化合物和靶点之间确有结合活性。GO分析表明四妙散中活性成分可能通过nuclear receptor activity等生物学过程,通过多靶点、多途径发挥治疗CP的功效。运用软件对筛选出的188个共同靶点进行KEGG富集分析,揭示秦氏四妙散治疗CP 通过调控TNF signaling pathway等机制,包括细胞凋亡、前列腺癌等信号通路,提示秦氏四妙散可通过多条通路对CP发挥治疗作用,同时对前列腺癌可能还有一定的抑制作用。
TNF-α属于一种促炎性细胞因子, 能够对单核巨噬细胞进行活化,提高其杀伤活性[17]。TNF-α可诱导PGE2水平上升,促使微血管扩张,引起局部组织水肿,痛觉受体敏感度增强,痛觉产生[18]。COX-2可以促进PGE2的合成,PGE2会增加机体对痛觉的敏感性。同时 COX-2还可以减少β-内啡肽表达,而β-内啡肽具有止痛的作用[19]。通过大鼠实验发现,秦氏四妙散干预后,大鼠前列腺组织病理损伤明显减轻,TNF-α、IL-6、IL-1β、COX-2、PGE2表达显著下降,其中以高剂量组效果最佳,中剂量组和低剂量组效果略低于高剂量组,说明四妙散可能通过调控TNF信号通路抑制TNF-α、IL-6、IL-1β、COX-2、PGE2的生成,有效缓解前列腺组织炎症反应。p38MAPK/NF-κB信号通路在介导炎症反应发生过程中发挥重要作用,p38MAPK是MAPK家族中的一个主要成员,是调控炎症反应的上游因子,NF-κB参与调控细胞凋亡、增殖、细胞应激反应、免疫和炎症反应的基因转录[20],是炎症反应的下游因子。在各种细胞外刺激作用下,p38MAPK被双磷酸化而激活,激活的p38MAPK能促进IκB双磷酸化和降解,使NF-κB释放并得以激活,移位进入细胞核,启动一系列基因的转录诱导炎症发生[21-23]。此外,还有研究显示CP的发生与JAK通路和ERK信号通路活化有关[24]。本实验证实秦氏四妙散能有效缓解CP与其中活性成分作用于TNF-α、IL-6、IL-1β、COX-2、PGE2等关键靶点有关,可能通过抑制TNF、PI3K/Akt、p38MAPK/NF-κB等信号通路,发挥调节炎症、免疫、改善前列腺组织微环境的作用,将在接下来的实验中进一步验证。
综上所述,本研究利用网络药理学和对秦氏四妙散治疗CP的活性成分、关键靶点及可能的作用机制进行分析,发现四妙散是以“多组分-多靶点-多通路”的方式发挥治疗作用;通过分子对接验证了化合物与靶点之间的结合活性;并结合动物实验初步证实秦氏四妙散治疗CP的有效性及其抗炎靶点。
参考文献
[1]Collins M M N, MacDonald R, Wilt T J. Interventions for chronic abacterial prostatitis[J]. Cochrane Database of Systematic Reviews, 1999 (4).
[2]Mehik A, Hellström P, Lukkarinen O, et al. Epidemiology of prostatitis in Finnish men: a population‐based cross‐sectional study[J]. BJU international, 2000, 86(4): 443-448.
[3]Stamey T A, Stamey T A. Pathogenesis and treatment of urinary tract infections[M]. Williams & Wilkins, 1980.
[4]Mehik A, Hellström P, Sarpola A, et al. Fears, sexual disturbances and personality features in men with prostatitis: a population‐based cross‐sectional study in Finland[J]. BJU international, 2001, 88(1): 35-38.
[5]Ku J H, Kim S W, Paick J S. Quality of life and psychological factors in chronic prostatitis/chronic pelvic pain syndrome[J]. Urology, 2005, 66(4): 693-701.
[6]Zhang Y, Zheng T, Tu X, et al. Erectile dysfunction in chronic prostatitis/chronic pelvic pain syndrome: outcomes from a multi-center study and risk factor analysis in a single center[J]. PLoS One, 2016, 11(4): e0153054.
[7]秦国政,张春和,李焱风,等.基于疮疡理论论治慢性前列腺炎专家共识[J].中医杂志,2017,58(05):447-450.
[8]张琳,赵梓邯,于冰莉,崔洁,侯俊玲,王文全.甘草地上部分对慢性前列腺炎大鼠的影响[J].中成药,2019,41(06):1407-1410.
[9]Grewal Amarjot Kaur,Singh Thakur Gurjeet,Sharma Deepak,Sharma Veerta,Singh Manjinder,Rahman Md. Habibur,Najda Agnieszka,Walasek-Janusz Magdalena,Kamel Mohamed,Albadrani Ghadeer M.,Akhtar Muhammad Furqan,Saleem Ammara,Abdel-Daim Mohamed M.. Mechanistic insights and perspectives involved in nfeuroprotective action of quercetin[J]. Biomedicine & Pharmacotherapy,2021,140.
[10]程丽艳,郑晓亮,史红.槲皮素对非细菌性前列腺炎治疗作用的实验研究.中国临床药理学与治疗学,2008,13(6):648-653.
[11]Shoskes DA,Zeitlin SI,Shahed A,et al.Quercetin in men with category iii chronic prostatitis:A preliminary prospective,double-blind,placebo-controlled trial.Urology,1999,54(6):960-963.
[12]Lu Chen,Kai Cao,Yurong Gu,Chao Luo,Wei Mao,Weijun Zhou,Jinwei Zhu,Huying Zhang. Kaempferol attenuates spinal cord injury by interfering inflammatory and oxidative stress by targeting the p53 protein: a molecular docking analysis[J]. Molecular & Cellular Toxicology,2021(prepublish).
[13]YE Y,HOU R,CHEN J,et al.Formononetin-induced apoptosis of human prostate cancer cells through ERK1/2 mitogen-activated protein kinase inactivation[J].Horm Metab Res,2012,44(4):263-267.
[14]Lee Ho K,Park Jinhong,Kim BoRahm,Jun Ikhyun,Kim TaeIm,Namkung Wan. Isorhamnetin Ameliorates Dry Eye Disease via CFTR Activation in Mice.[J]. International journal of molecular sciences,2021,22(8).
[15]Wang Chunyan,Luo Jingjing,Bai Xiaoxue,Hua Shucheng,Jie Jing,Liu Han,Gao Jinying,Song Lei,Hu Weicheng. Calycosin Alleviates Injury in Airway Epithelial Cells Caused by PM 2.5 Exposure via Activation of AMPK Signalling[J]. Evidence-Based Complementary and Alternative Medicine,2021,2021.
[16]Gong Guowei,Zheng Yuzhong,Yang Yang,Sui Yixuan,Wen Zhen,Cioanca Oana. Pharmaceutical Values of Calycosin: One Type of Flavonoid Isolated from[J]. Evidence-Based Complementary and Alternative Medicine,2021,2021.
[17]Ardelean DS, Dent PB, Ferguson PJ, et al.Chronic nonbacterial osteomyelitis in a child with previous juvenile dermatomyositis[J].J Rheumatol, 2013, 40 (3) :339-340.
[18]杨杰.Ⅲ型前列腺炎患者前列腺按摩液中NE,pH,IL-1β,TNF-α及PGE2的变化及其意义[J].临床与病理杂志,2018,38(12):2583-2588.
[19]魏山尊, 熊坤林, 张伟国, 等.α-受体阻滞剂联合Cox-2抑制剂对Ⅲb型前列腺炎患者的疗效观察[J].第三军医大学学报, 2015, 37 (11) :1166-1170.
[20] Perkins N D. Integrating cell-signalling pathways with NF-κB and IKK function [J]. Nat Rev Mol Cell Biol, 2007, 8(1): 49-62.
[21]Ma J, Liang H, Jin H R, et al.Yangonin Blocks Tumor Necrosis Factor-α-Induced Nuclear Factor-κB-Dependent Transcription by Inhibiting the Transactivation Potential of the Rel A/p65 Subunit.Journal of Pharmacological Sciences, 2012, 118 (4) :447-454.
[22]Liu S, Misquitta Y R, Olland A, et al.Crystal structure of a human IκB kinaseβasymmetric dimer.Journal of Biological Chemistry, 2013, 288 (31) :22758-22767.
[23]Hochrainer K, Racchumi G, Anrather J.Site-specific phosphorylation of the p65 protein subunit mediates selective gene expression by differential NF-κB and RNA polymeraseⅡpromoter recruitment.Journal of Biological Chemistry, 2013, 288 (1) :285-293.
[24]艾依热提·买买提,木拉提·热夏提.龙胆苦苷对慢性前列腺炎的作用及对NF-κB和MAPKs信号通路活化的研究[J].实用药物与临床,2021,24(02):111-115.



