梅佳华1,2,查学志1,柯瑾1,3,杨蕊萍1,杨丽娟1,程炳铎1,李姓喜1,马云淑
[作者简介]梅佳华,博士生,研究方向:中药新剂型与新制剂,E-mail:Highwaydo@163.com
[通讯作者]马云淑,博士,教授,博导,研究方向:中药新剂型与新制剂,E-mail:yunshuma2@126.com]
1.云南中医药大学,云南昆明650500
2.云南省南药可持续利用研究重点实验室,云南昆明650500
3.云南省傣医药与彝医药重点实验室,云南昆明650500
4.云南省高校外用给药系统与制剂技术研究重点实验室,云南昆明650500
5.云南省药食同源饮片工程中心,云南昆明650500
摘要:目的优选虎力散(HuliSan,HLS)的最佳提取工艺,为其制剂的二次开发提供依据。方法建立指标成分8-去乙酰滇乌碱(8-deacetyl yunaconitine,8D-YNA)、滇乌碱(yunaconitine,YNA)、三七皂苷R1(notoginsenoside R1,NG-R1)、人参皂苷Rg1(ginsenoside Rg1,G-Rg1)、人参皂苷Rb1(ginsenoside Rb1,G-Rb1)、告达亭(caudatin,CAU)和党参炔苷(lobetyolin,LOB)的UPLC测定方法,以指标成分含量、出膏率为关键质量属性(critical quality attributes,CQAs),采用AHP-熵权法结合化学计量学确定各指标的组合权重系数,在单因素试验的基础上,采用Box-Behnken响应面法优化HLS提取工艺。结果Box-Behnken设计建立的模型显著,HLS的最佳提取工艺为加10倍量60%乙醇溶液,提取时间2 h,提取2次,此条件下综合评分为0.659 2,工艺验证结果与模型预测结果相近,RSD<3%,表明建立的模型可用于HLS提取工艺的分析和预测。结论采用AHP-熵权法结合化学计量学优选HLS提取工艺,所建立的模型可靠,提取工艺稳定可行,为民族药HLS制剂的二次开发提供依据。
关键词:虎力散;提取工艺;AHP;熵权法;Box-Behnken响应面法;化学计量学
Research on the extraction process of ethnomedicine HuLisan based on AHP-entropy weight method and chemometrics
MEI Jia-hua1,2,ZHA Xue-zhi1,3,KE Jin1,YANG Rui-ping1,YANG Li-juan1,CHENG Bing-duo1,LI Xing-xi1,MA Yun-shu1,3,4,5*
1.Yunnan University of Chinese Medicine,Kunming 650500,China;
2.Yunnan Key Laboratory of Southern Medicinal Utilization,Kunming 650500,China
3.Yunnan Key Laboratory of Dai and Yi medicines,Kunming 650500,China
4.The Key Laboratory of External Drug Delivery System and Preparation Technology in University of Yunnan Province,Kunming 650500,China
5.Engineering Research Center for Medicine and Food Homologous Beverage of Yunnan Province,Kunming 650500,China
Abstract:Objective To optimal extraction process of HuLiSan(HLS)and to provide a basis for the secondary development of its preparation.Methods A UPLC method was established for the determination of 8-deacetyl yunaconitine,yunaconitine,notoginsenoside R1,ginsenoside Rg1,ginsenoside Rb1,caudatin and lobetyolin,with the content of the index components and the rate of paste as the key quality attributes,and the combined weighting coefficients of the indexes were determined by AHP-entropy weight method combined with chemometrics,and the extraction process for HLS was optimized by the Box-Behnken response surface method based on the one-way test.Results The model established by Box-Behnken design was significant,and the optimal extraction process of HLS was 10 times the amount of 60%ethanol solution,extraction time of 2 h,and two times of extraction,and the comprehensive score was 0.659 2 under this condition,and the results of process validation were similar to those predicted by the model with an RSD<3%,indicating that the established model can be used for the analysis and prediction of HLS extraction process.Conclusion The AHP-entropy weight method combined with chemometrics was used to preferentially select the HLS extraction process,and the established model was reliable and the extraction process was stable and workble,which provides a basis for the secondary development of HLS preparations of ethnomedicines.
Key words:Hulisan;extraction process;analytic hierarchy process;Box-Behnken response surface methodology;chemometrics
虎力散[1](Hu Li San,HLS)是彝族名医曲焕章先生创制的秘方,收载于《卫生部药品标准中药成方制剂(第十册)》,由制草乌、三七、白云参和断节参四味药组成,具有驱风除湿,舒筋活络和消肿定痛的功效,临床用于风湿麻木,筋骨疼痛、跌打损伤和创伤流血,疗效显著[2]。现代药理研究表明,HLS中4味药在抗炎镇痛方面具有疗效[3-4],且制草乌和三七通过抑制破骨细胞和软骨细胞降解、促进成骨细胞增殖等方面发挥抗关节炎作用[5-6],可见HLS具有良好的开发前景。
2023年《膝骨关节炎中西医结合诊疗专家共识》中把HLS作为推荐中成药,且临床报道显示,HLS内服、外用或内外联合用于膝骨关节炎等疾病,疗效显著[7-8]。目前仅有虎力散、虎力散片和虎力散胶囊3种口服制剂,临床外用多临时调敷,缺乏质量稳定可靠的外用制剂,因此开展HLS外用制剂研发具有重要意义。课题组欲将其制成改良型新药虎力散凝胶贴膏,以满足临床用药需求,同时克服肝脏首过效应、不能随时停止给药等缺点。HLS以饮片直接打粉入药,而生药粉不利于经皮吸收,故本研究拟将HLS通过乙醇提取以更大程度的提取药效成分。
根据质量源于设计理念,中药制剂的开发应该严格选择关键质量属性(critical quality attributes,CQAs),以更好的对关键工艺参数(critical process parameters,CPPs)进行优化[9]。根据HLS化学成分及药典中规定,选取制草乌中8-去乙酰滇乌碱(8-deacetyl yunaconitine,8D-YNA)、滇乌碱(yunaconitine,YNA)、三七中三七皂苷R1(notoginsenoside R1,NG-R1)、人参皂苷Rg1(ginsenoside Rg1,G-Rg1)、人参皂苷Rb1(ginsenoside Rb1,G-Rb1)、白云参中党参炔苷(lobetyolin,LOB)和断节参中告达亭(caudatin,CAU)为指标成分。以指标成分含量和出膏率为CQAs,采用主观评价层次分析法(analytic hierarchy process,AHP)和熵权法[10-11],结合聚类分析(hierarchical cluster analysis,HCA)、主成分分析(principal component analysis,PCA)和偏最小二乘判别分析(partial least-squares discrimination analysis,PLS-DA)等化学计量学方法[12],从主观和客观两个维度确定各指标的综合权重。
因此,本研究以各味药材中指标成分含量和出膏率为CQAs,以乙醇用量、乙醇体积分数、提取时间和提取次数为CPPs,采用AHP-熵权法结合化学计量学确定指标综合权重,利用Box-Behnken响应面法进行模型预测,以期得到合理、稳定、可靠的提取工艺,为民族药HLS外用制剂开发和质量控制研究提供实验依据。
1仪器与试药
1.1仪器
Agilent 1290 Series超高效液相色谱仪,美国Agilent公司;R2000-30型万分之一电子天平,奥豪斯仪器有限公司;MH-2000型电热套,北京中兴伟业仪器有限公司;1000克摇摆式高速多功能粉碎机,温岭市林大机械有限公司;101-2AB型电热鼓风干燥箱,天津市泰斯特仪器股份有限公司;UPR-II-10TNZP型超纯水机,四川优普超纯科技有限公司;GL16M型高速冷冻离心机,湖南迈达仪器有限公司。
1.2试药
制草乌(202311)、三七(202312)、白云参(202311)、断节参(202311)由云南云河药业股份有限公司提供,经云南中医药大学张洁教授鉴定,制草乌是毛茛科乌头属植物黄草乌(Aconitum vilomriniannum Kom.)的干燥块根后的炮制品,三七为五加科植物三七Pan ax notoginseng(Burk.)F.H.Chen的干燥根和根茎,白云参为桔梗科金钱豹属植物大花金钱豹Campanumoea javanica BI.的根,断节参是萝藦科鹅绒藤属植物昆明杯藤Cynanchum wallichii Wight的根。
对照品三七皂苷R1(批号110745-202322,纯度>98%)、人参皂苷Rg1(批号110703-202235,纯度>98%)、人参皂苷Rb1(批号110704-202331,纯度>98%),购自中国食品药品检定研究院;对照品滇乌碱(DST220425-058,纯度98.89%)、8-去乙酰滇乌碱(DST230131-369,纯度98.46%),购自成都乐美天医药科技有限公司。对照品告达亭(批号070148-202308,纯度99.46%)、党参炔苷(批号040019-202301,纯度99.19%),购自森岚科技有限公司。乙腈、甲醇、磷酸、三乙胺,色谱级,Thermo Scientific公司;无水乙醇,分析纯,天津致远化学试剂有限公司;水,自制。
2方法与结果
2.1 HLS提取液的制备称取制草乌70 g,三七10 g,白云参15g,断节参5 g,置于2 L圆底烧瓶中,加一定倍量不同浓度的乙醇溶液,加热回流提取,以100目滤布过滤,即得。
2.2 YNA、8D-YNA含量测定
2.2.1对照品溶液的制备分别精密称取YNA、8D-YNA对照品(结构见图1)适量,加甲醇溶解制成质量浓度分别为13.38、7.99 mg/mL的贮备液,分别精密吸取贮备液1.0 mL,置于同一10 mL量瓶中,甲醇稀释定容至刻度,即得。
图1 8-去乙酰滇乌碱和滇乌碱化学结构
2.2.2供试品溶液的制备吸取HLS提取液适量于1 mL离心管中,10000 r/min离心5 min,取上清液过0.22μm微孔滤膜,即得供试品溶液。
2.2.3阴性样品溶液的制备按处方量称取缺制草乌的粉末,按“2.1”项下方法制备提取液,按“2.2.2”项下方法制备,即得阴性样品溶液。
2.2.4色谱条件及专属性考察采用InfinityLab Poroshell HPH-C18(2.1 mm×150 mm,2.7µm)色谱柱;流动相乙腈(A)-0.2%三乙胺溶液(B)(磷酸调节PH至5.0),梯度洗脱:0~5 min,15~26%A,5~7 min,26~35%A,7~10 min,35%A,柱温35℃,流速0.6 mL/min,进样量10μL,检测波长206 nm,见图2,各成分分离良好,阴性样品无干扰。
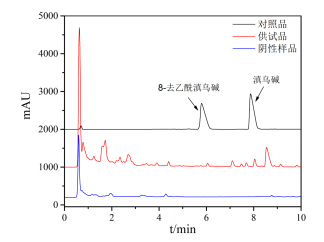
图2 8D-YNA和YNA UPLC图
2.2.5线性关系考察取“2.2.1”项下对照品溶液逐级稀释,按“2.2.4”项下色谱条件进样检测,以质量浓度为横坐标(X),峰面积为纵坐标(Y)进行线性回归,得回归方程为YNA Y=43001 X+39.748,R2=0.999 9,线性范围3.3~418.1μg/mL,8D-YNA Y=17579X–63.619,R2=0.999 4,线性范围1.95~249.7μg/mL。
2.2.6精密度考察取“2.2.1”项下对照品溶液,按“2.2.4”项下色谱条件连续进样6次,测得YNA峰面积的RSD为0.29%,8D-YNA峰面积的RSD为0.25%,表明仪器精密度良好。
2.2.7稳定性考察取“2.2.2”项下供试品溶液,按“2.2.4”项下色谱条件分别在0、2、4、6、8、10、12、24 h进样分析,测得YNA峰面积的RSD为3.62%,8D-YNA峰面积的RSD为0.53%,表明样品在24 h内稳定性良好。
2.2.8重复性考察精密称定HLS 6份,按“2.2.2”项下条件制备6份供试品溶液,按“2.2.4”项下色谱条件进样检测,测得YNA含量的RSD为0.43%,8D-YNA含量的RSD为3.55%。
2.2.9加样回收率考察精密量取已知含量的样品0.5 mL,加入对照品0.5 mL,摇匀,过0.22μm微孔滤膜,按“2.2.4”项下条件进样分析,计算加样回收率,结果表明,YNA的平均加样回收率为99.63%,RSD为0.68%;8D-YNA的平均加样回收率为99.76%,RSD为0.98%,表明该方法准确度良好。
2.3 NG-R1、G-Rg1和G-Rb1含量测定
2.3.1对照品溶液的制备分别精密称取NG-R1、G-Rg1、G-Rb1对照品(化学结构见图3)适量,加甲醇制成质量浓度分别为5.24、5.67、5.63 mg/mL的贮备液,分别精密吸取贮备液1.0 mL,置于同一10 mL量瓶中,甲醇稀释定容至刻度,即得。
图3三七皂苷R1、人参皂苷Rg1和人参皂苷Rb1化学结构
2.3.2供试品溶液的制备同“2.1”项下供试品溶液的制备方法。
2.3.3阴性样品溶液的制备按处方量称取缺三七的粉末,同“2.1”项下方法制备。
2.3.4色谱条件及专属性考察采用InfinityLab Poroshell HPH-C18(2.1 mm×150 mm,2.7µm)色谱柱;流动相乙腈(A)-水(B),梯度洗脱:0~5 min,18~26%A,5~9 min,26~45%A,9~12 min,45%A,柱温35℃,流速0.3 mL/min,进样量5μL,检测波长203 nm,见图4,各成分之间分离良好,阴性样品无干扰。
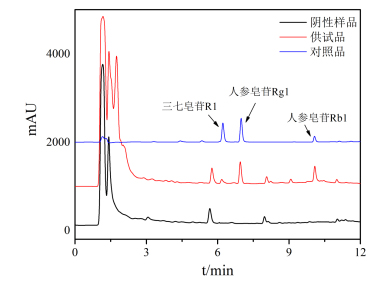
图4 NG-R1、G-Rg1和G-Rb1 UPLC图
2.3.5线性关系考察取“2.3.1”项下对照品溶液逐级稀释,按“2.3.4”项下色谱条件进样分析,以质量浓度为横坐标(X),峰面积为纵坐标(Y)进行线性回归,得回归方程为:NG-R1 Y=4601.3 X+71.359 8,R2=0.999 3,线性范围为3.4~1746.7μg/mL,G-Rg1 Y=4953.6 X+73.236,R2=0.999 6,线性范围为3.7~1890.0μg/mL,G-Rb1 Y=3830.1 X+42.362,R2=0.999 5,线性范围为3.7~1876.7μg/mL。
2.3.6精密度考察取“2.3.1”项下对照品溶液连续进样6次分析,测得NG-R1峰面积的RSD为0.36%,G-Rg1峰面积的RSD为0.37%,G-Rb1峰面积的RSD为0.36%,表明仪器精密度良好。
2.3.7稳定性考察取“2.3.2”项下供试品溶液,按“2.3.4”项下条件分别在0、2、4、6、8、10、12、24 h进样分析,测得NG-R1峰面积的RSD为1.33%,G-Rg1峰面积的RSD为0.62%,G-Rb1峰面积的RSD为0.41%,表明HLS样品在24 h内稳定性良好。
2.3.8重复性考察精密称定HLS 6份,按“2.3.2”项下方法制备供试品溶液,按“2.3.4”项下色谱条件进样检测,测得NG-R1含量的RSD为2.00%,G-Rg1含量的RSD为0.99%,G-Rb1峰面积的RSD为1.96%,表明方法重复性良好。
2.3.9加样回收率考察精密量取已知含量的样品0.5 mL,加入对照品0.5 mL,摇匀,过0.22μm微孔滤膜,按“2.3.4”项下色谱条件进样分析,计算加样回收率,结果表明,NG-R1的平均加样回收率为99.27%,RSD为0.74%,G-Rg1的平均加样回收率为99.72%,RSD为0.52%,G-Rb1的平均加样回收率为98.23%,RSD为0.92%,表明该方法准确度良好。
2.4 CAU、LOB UPLC方法的建立
2.4.1对照品溶液的制备分别精密称取CAU、LOB对照品(化学结构见图5)适量,加甲醇制成质量浓度分别为7.55、6.7 6mg/mL的贮备液,分别精密吸取贮备液1.0 mL,置于同一10 mL量瓶中,甲醇稀释定容至刻度,即得。
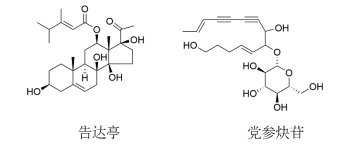
图5告达亭和党参炔苷化学结构
2.4.2供试品溶液的制备同“2.1”项下供试品溶液的制备方法。
2.4.3阴性样品溶液的制备称取处方量缺白云参和断节参的粉末,按“2.1”项下方法制备。
2.4.4色谱条件及专属性考察采用InfinityLab Poroshell HPH-C18(2.1 mm×150 mm,2.7µm)色谱柱;流动相乙腈(A)-水(B),梯度洗脱:0~2 min,25~29%A,2~4 min,29%A,4~5 min,29~50%A,5~12 min,50%A,柱温30℃,流速0.2 mL/min,进样量5μL,检测波长220 nm,见图6,各成分分离良好,阴性样品无干扰。
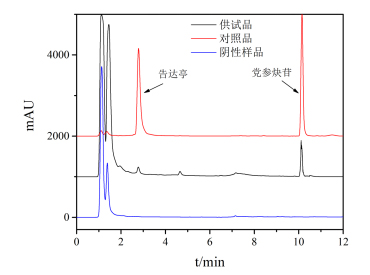
图6 CAU和LOB UPLC图
2.4.5线性关系考察取“2.4.1”项下对照品溶液逐级稀释,按“2.4.4”项下色谱条件进样分析,以质量浓度为横坐标(X),峰面积为纵坐标(Y)进行线性回归,得回归方程:CAU Y=29377 X+34.877,R2=0.999 4,线性范围为0.9~118.0μg/mL,LOBY=32661 X+45.569,R2=0.999 6,线性范围为0.0009~0.112μg/mL。
2.4.6精密度考察取“2.4.1”项下对照品溶液,按“2.4.4”项下色谱条件连续进样6次,测得CAU峰面积的RSD为1.10%,LOB峰面积的RSD为0.14%。
2.4.7稳定性考察取“2.4.2”项下供试品溶液,按“2.4.4”项下色谱条件分别在0、2、4、6、8、10、12、24 h进样分析,测得CAU峰面积的RSD为1.46%,LOB峰面积的RSD为1.50%,表明HLS样品在24 h内稳定性良好。
2.4.8重复性考察精密称定HLS 6份,按“2.4.2”项下方法制备供试品溶液,按“2.4.4”项下色谱条件进样检测,测得CAU含量的RSD为1.44%,LOB含量的RSD为1.23%。
2.4.9加样回收率考察精密量取已知含量的样品0.5 mL,加入对照品0.5 mL,摇匀,过0.22μm微孔滤膜,按“2.4.4”项下条件进样分析,计算加样回收率,结果表明,CAU的平均加样回收率为98.72%,RSD为2.73%。LOB的平均加样回收率为98.11%,RSD为2.60%,表明该方法准确度良好。
2.5出膏率的测定
取干燥至恒重的蒸发皿,记录质量(M1);精密量取HLS提取液50 mL,置于蒸发皿中,水浴蒸干,于105℃烘箱干燥至恒重,取出放入干燥器,待冷却后称重,记录质量(M2),按公式(1)计算出膏率。

2.6单因素考察
2.6.1乙醇用量
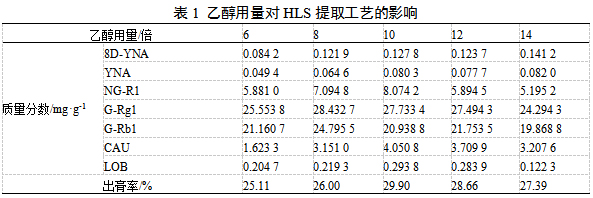
取HLS饮片100 g置于2 L圆底烧瓶中,分别加入6、8、10、12、14倍量70%乙醇,回流提取2 h,测定指标成分的含量和出膏率。由表1可知,各成分含量和出膏率呈先升高后降低的趋势,其中8D-YNA、YNA、NG-R1、CAU和LOB在10倍时达到峰值,G-Rg1和G-Rb1在8倍时达到峰值,在12倍条件下,各成分含量和出膏率均高于6倍和14倍,故选择8、10、12倍进行响应面试验。
2.6.2乙醇体积分数
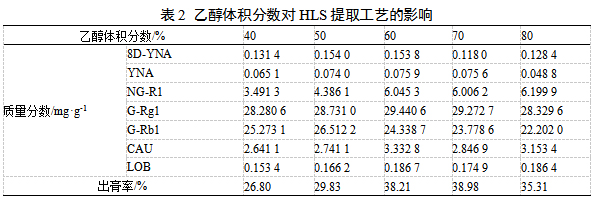
取HLS饮片100 g置于2 L圆底烧瓶中,分别加入10倍量40、50、60、70、80%乙醇,回流提取2h后检测,由表2可知,各成分含量及出膏率均呈现出先升高后降低的趋势,其中8D-YNA、G-Rb1在50%时达到峰值,YNA、NG-R1、G-Rg1、CAU和LOB在60%时达到最大值,相较于40%,各成分含量和出膏率均在70%时更优,故选择50%、60%、70%进行响应面试验。
2.6.3提取时间
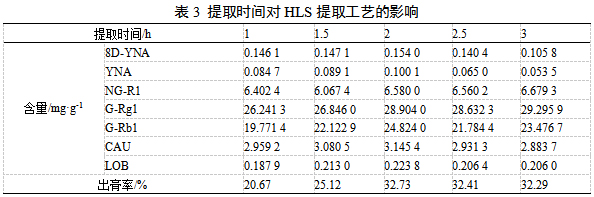
取HLS饮片100 g置于2 L圆底烧瓶中,加10倍量70%乙醇,分别回流提取1、1.5、2、2.5、3h后检测,由表3可知,各成分含量和出膏率均在2h时达到峰值,整体呈现先升高后降低的趋势,故选择1、2、3h进行响应面试验。
2.6.4提取次数
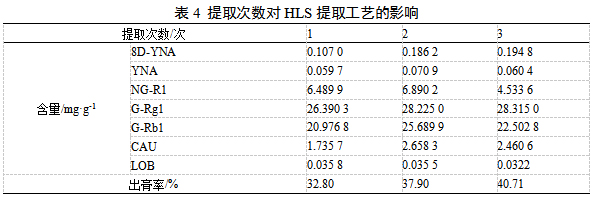
取HLS饮片100 g置于2 L圆底烧瓶中,加10倍量70%乙醇,提取2h,分别提取1、2、3次后检测,由表4可知,8D-YNA、G-Rg1含量和出膏率随着提取次数增加,含量和出膏率呈升高趋势,YNA、NG-R1、G-Rb1、CAU和LOB呈现出先升高后降低的趋势。整体相比,提取2次优于提取3次,故提取次数确定为2次。
2.7响应面试验设计
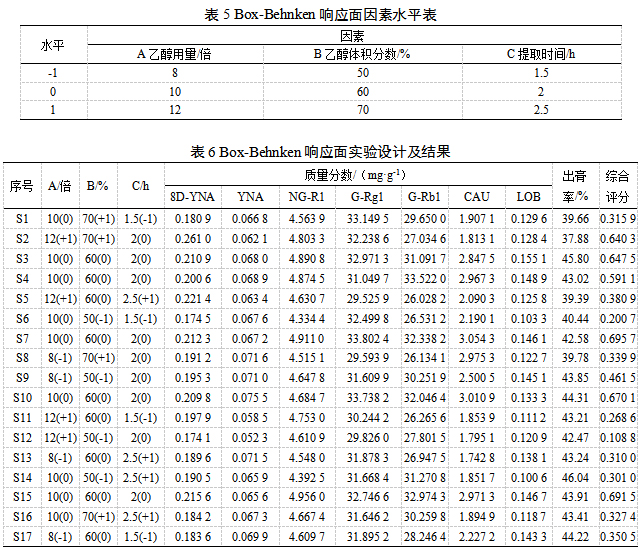
2.7.1 CQAs和CPPS的确定在单因素的基础上,采用Box-Behnken响应面法优化HLS提取工艺。以8D-YNA、YNA、NG-R1、G-Rg1、G-Rb1、CAU和LOB含量及出膏率为CQAs,乙醇用量(A)、乙醇体积分数(B)和提取时间(C)为CPPs。
2.7.2 Box-Beheken试验设计及结果利用Design-Expert 11软件设计3因素3水平的17次试验,实验因素水平、实验设计及结果见表5~6。
2.8化学计量学研究
2.8.1层次聚类分析(HCA)采用SPSS 26.0软件,以各成分含量为变量,以平方欧氏距离为测度进行分析。由图7可知,当欧氏距离为15时,HLS提取液聚为2类,S4、S14~S16为一类,其余为另一类;当欧氏距离为10时,响应面实验所得17种HLS提取液聚为3类,S1、S2、S6、S9、S11、S13、S17为第1类,S3、S5、S7、S8、S10、S12为第2类,S4、S14~S16为第3类。
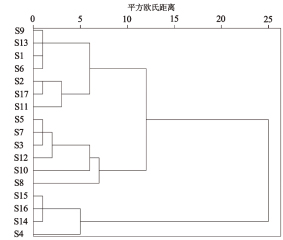
图7 Box-Behnken响应面设计所得溶液HCA图
2.8.2主成分分析(PCA)
采用SIMCA14.1软件,以各成分含量为变量进行分析。其中主成分1方差贡献率为33.9%,前3个主成分的累积共贡献率为87.34%。由图8可知,17批HLS提取液均在置性区间内,说明各批次样品有较好的一致性,且结果可聚为3类,与HCA结果一致。
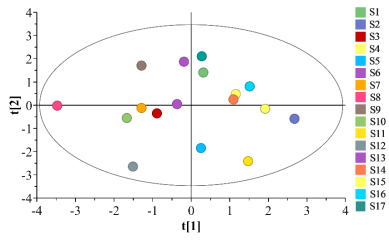
图8 Box-Behnken响应面设计所得溶液PCA得分图
2.8.3偏最小二乘判别分析(PLS-DA)
采用SIMCA14.1软件,以各成分含量为变量进行分析。由图9可知,17批HLS提取液聚为3类,与上述结果一致。变量投影重要性(variable importance in projection,VIP)值越大,对模型的贡献越高。以VIP值>1为指标,筛选得到2种符合要求的成分,VIP值由高到低依次分别是G-Rb1和G-Rg1,来源于HLS臣药三七,表明三七对全方的提取液质量的影响较大,结果见图7。
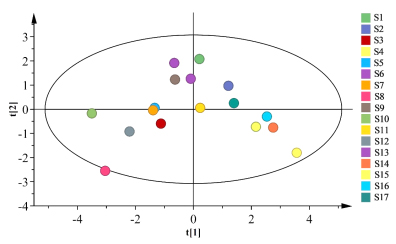
图9 Box-Behnken响应面设计所得溶液OPLS-DA得分图
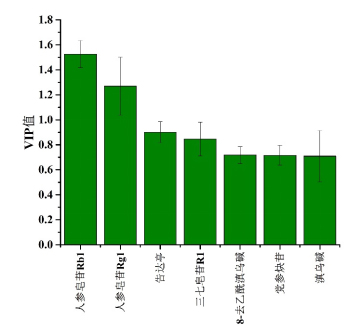
图7各成分含量VIP图
2.9 AHP-熵权法组合赋权
2.9.1 AHP计算评价指标主观权重(W1)根据君臣佐使原则,将方中有效成分G-Rb1(A1)、G-Rg1(A2)、CAU(A3)、NG-R1(A4)、8D-YNA(A5)、LOB(A6)和YNA(A7)含量及出膏率(A8)作为评价指标,依据化学计量学分析,G-Rb1(A1)和G-Rg1(A2)同等重要,二者优于CAU(A3)和NG-R1(A4),YNA具有毒性,而8D-YNA是制草乌炮制后产生的无毒且有效的成分,因此8D-YNA(A5)优于YNA(A7),和LOB(A6)同等重要,同时实验结果发现各个水平的出膏率差异不明显,故8个评价指标的优先顺序A1=A2>A3>A4>A5=A6>A7=A8,构建成对比较的判断优先矩阵,结果见表7。
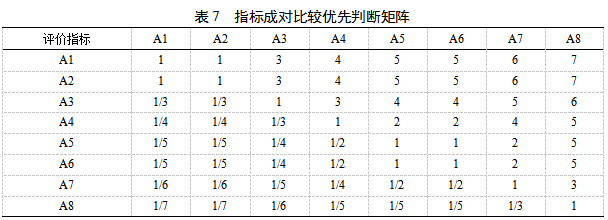
按公式(2)计算初始权重系数wi',并按公式(3)计算归一化权重系数wi。一致性比率(CR)用公式(4)计算,来衡量权重系数是否合理,经计算CR=0.050 1<0.1,满足一致性要求,表明指标合理可行。
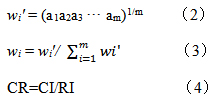
2.9.2熵权法计算评价指标客观权重(W2)
(1)标准化处理试验中指标成分和出膏率,其数值越大越好,均为正向指标,为使数据处理更有意义,可将标准化处理后的数据全部平移一个最小单位值,以满足运算要求,但以不破坏原始数据内在规律为原则,其取值a应尽可能的小,故本实验取a=0.0001,按公式(5)计算,式中xij为i次试验中j指标试验值,Mi为该组试验中最大值,mi为最小值。
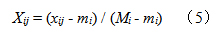
(2)根据信息熵定义,按公式(6)(7)计算各指标的熵值。
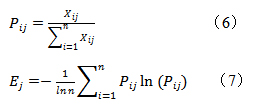
(3)按公式(8)计算指标权重系数。
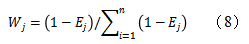
2.9.3综合权重的确定设主观权重为W1,客观权重为W2,则组合权重W按公式(9)计算,结果见表8。
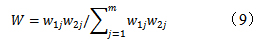
2.10响应面结果分析
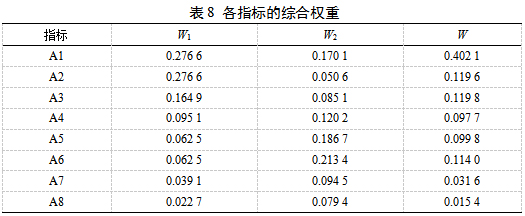
利用Design-Expert 11软件对AHP-熵权法综合评分结果进行工艺参数优化,建立3个因素的二次回归模型方程:Y=-6.650 5+0.005 5 A+0.121 8 B+3.394 5 C+0.008 2 AB+0.038 2 AC-0.004 4 BC-0.028 8 A2-0.001 6 B2-0.866 0 C2,对实验模型进行方差分析,结果见表9。乙醇体积分数(B)的P值<0.05,说明该因素对HLS的提取工艺有显著影响。该模型的F值为25.74(P=0.0001<0.05),具有统计学意义,失拟项0.2992>0.05,不显著,说明该模型具有可靠性。同时,调整决定系数R2adj=0.9329,说明HLS提取工艺AHP-熵权法综合评分93.29%来自于加醇倍数、乙醇体积分数和提取时间。总决定系数R2=0.9707,说明二次模型拟合度较好,实验值与预测值之间相关性较好,可用于HLS提取工艺的分析和预测。
响应面图圆形表示两因素交互作用较弱,椭圆表示两因素交互作用较强,因素交互作用结果见图10。可知,加醇倍数和乙醇体积分数的交互作用对综合评分具有显著影响。
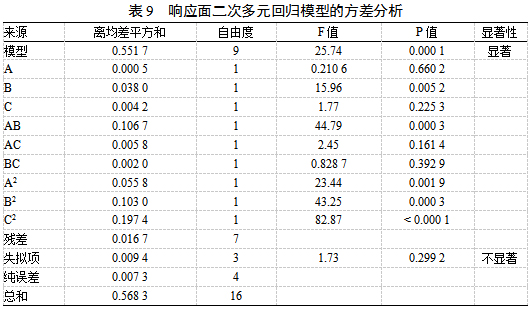
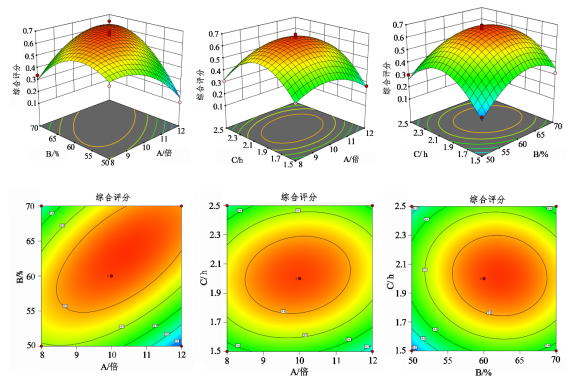
图10各因素对综合评分的影响
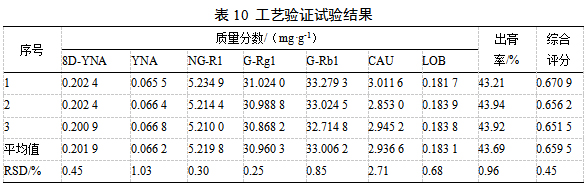
2.11工艺验证
应用软件预测HLS提取工艺的理论最佳条件为乙醇用量10倍,乙醇体积分数60%,提取时间2 h,综合评分为0.659 2。按最佳工艺进行3批工艺验证,结果见表10,平均综合评分为0.6595,RSD为1.53%,说明预测结果与实际结果有良好的相关性。3批次工艺验证各指标成分含量及出膏率的RSD均小于3%,证明试验模型预测的工艺稳定、可行。
3小结与讨论
HLS临床多外敷于患者疼痛处,疗效显著,但目前仅有散剂、片剂和胶囊剂3种口服制剂,课题组欲将其制成外用制剂,以弥补HLS外用制剂的缺陷。全方打粉入药,而以中药粉为原料药制备的外用制剂,经皮吸收效果不如提取物。故前期以8种有效成分含量为指标,采用薄层色谱和液相色谱2种方法,考察乙醇回流提取、乙醇超声提取和水提的影响,结果显示乙醇回流提取对8种成分的提取率更高,且更符合现代化大生产的要求,因此采用乙醇回流提取对HLS提取工艺进行优化。
HLS中制草乌能祛风通络、散寒除湿,YNA和8D-YNA是主要活性成分,其中8D-YNA是草乌炮制后YNA降解产生的单酯型生物碱,毒性降低[13]但仍具有镇痛活性[14]。三七在活血、止血、抗炎等方面均具有作用,2020版《中国药典》规定三七含量测定指标成分为NG-R1、G-Rg1和G-Rb1,其中NG-R1抗炎和调节免疫功能等作用[15];G-Rg1能够抑制软骨细胞凋亡和炎症介质活性[16-17],同时通过抑制NF-B通路来发挥软骨保护作用[18];G-Rb1通过抑制炎症细胞因子(NO、PEG2等)的表达来保护关节软骨,同时通过Notch、NF-B等信号通路来发挥治疗关节炎的作用[19]。断节参和白云参补肝肾、强筋骨,其中CAU和LOB分别是其中含量测定的指标成分,四味组方科学、标本兼治、祛邪扶正,共奏祛风除湿、舒筋活络、活血化瘀、消肿止痛之功。因此,本研究选择HLS 4味药的指标成分进行提取工艺质量控制。
本研究采用单因素考察和Box-Behnken响应面优化,考察乙醇用量、乙醇体积分数和提取时间对HLS提取工艺的影响,同时基于AHP-熵权法及化学计量学的方法建立HLS提取工艺评估模型,以指标成分8D-YNA、YNA、NG-R1、G-Rg1、G-Rb1、CAU和LOB含量对提取工艺进行评价,能够快速、准确地筛选出CPPs,为后续制剂生产过程中的质量控制奠定基础,实现全过程质量统一监控。以出膏率评价全方质量,保证制剂持续生产安全有效。将AHP主观评分和熵权法客观评分相结合,赋权各指标权重系数,计算8个指标的综合评分,分析各因素间的交互作用,更清晰和客观的分析各成分在不同提取条件下的变化规律,避免指标间的相互影响,筛选出最佳提取工艺为乙醇用量10倍,乙醇体积分数60%,提取时间2h,提取次数2次,工艺验证表明,预测结果和实际结果相近,RSD<3%,建立的模型可用于HLS提取工艺的分析和预测,可为民族药HLS制剂的二次开发提供实验依据。
利益冲突所有作者均声明不存在利益冲突
参考文献
[1]刘剑.一种虎力散外用制剂及其制备方法[P].云南:CN201310743005.9,2014-05-28.
[2]伏敏睿,何丽芳,吕健,等.虎力散胶囊治疗膝骨关节炎有效性与安全性的Meta分析[J].中国中药杂志,2022,47(19):5365-5374.
[3]Li M,He J,Jiang L L,et al.The anti-arthritic effects of Aconitum vilmorinianum,a folk herbal medicine in Southwestern China.J Ethnopharmacol.2013,147(1):122-7.
[4]Kim M K,Kang H,Baek C W,et al.Antinociceptive and anti-inflammatory effects of ginsenoside Rf in a rat model of incisional pain.J Ginseng Res.2018,42(2):183-191.
[5]Huang L,Li Q.Notoginsenoside R1 promotes differentiation of human alveolar osteoblasts in inflammatory microenvironment through inhibiting NF κB pathway and activating Wnt/β catenin pathway.Mol Med Rep.2020,22(6):4754-4762.
[6]Ma X,Zhang X,Kong Y,et al.Therapeutic effects of Panax notoginseng saponins in rheumatoid arthritis:network pharmacology and experimental validation.Bioengineered.2022 Jun;13(6):14438-14449.
[7]张家雯,袁云东,王艳君,等.虎力散内服外用治疗寒湿阻络型膝骨关节炎的临床效果[J].中国医药导报,2021,18(21):75-78+91.
[8]张清,白云静,纪泉,等.虎力散胶囊外敷治疗膝骨关节炎的有效性与安全性研究[J].中华关节外科杂志(电子版),2015,9(05):603-607.
[9]牛成琳,殷洪梅,宋明明,等.基于改进AHP-熵权-关联度及化学计量学的经典名方一贯煎提取工艺研究[J].中草药,2024,55(04):1178-1188.
[10]王晓丽,沈哲苑,李丽萍,等.基于正交试验结合基准关联度和AHP-熵权法优化经典名方黄连汤提取工艺[J].中草药,2023,54(15):4804-4811.
[11]癿蕾,何红杰,冯晓莉,等.基于响应面法结合AHP-熵权法及指纹图谱的黄芪纳滤浓缩浸膏真空干燥工艺研究[J].时珍国医国药,2023,34(06):1375-1379.
[12]汪杰,刘宇洁,张静,等.基于化学计量法和指纹图谱对生姜不同处理方法的成分差异研究[J].中草药,2024,55(09):3107-3115.
[13]黎虽宇,刘小赟,唐春萍,等.黄草乌炮制前后生物碱含量及心脏毒性差异研究[J].中草药,2018,49(23):5588-5593.
[14]陈聚峰,苏东雪,黄华珍,等.不同炮制工艺制黄草乌毒性及镇痛作用的初步考察[J].中国医院药学杂志,2023,43(22):2471-2477.
[15]Huang Y M,Wu D Y,Fan W M.Protection of ginsenoside Rg1 on chondrocyte from IL-1b-induced mitochondria-activated apoptosis through PI3K/Akt signaling[J].Molecularand Cellular Biochemistry,2014,392(1):249-257.
[16]Cheng W D,Jing J H,Wang Z,et al.Chondroprotective effects of ginsenoside Rg1 in human osteo arthritis chondrocytes and a rat model of anterior cruciate ligament transection[J].Nutrients,2017,9(3):263-275.
[17]段超,彭锐,熊勇,等.人参皂苷Rg1对兔膝早期骨性关节炎软骨细胞增殖影响的体内实验研究[J].湖北中医药大学学报,2016,18(01):19-23.
[18]Arvinthana,Hossainma,Kimb,et al.Ginsenoside Rb1 inhibits monoiodoacetate-induced osteoarthritis in postmenopausal rats through prevention of cartilage degradation[J].Journal of Ginseng Research,2021,45(2):287-294.
[19]Hossainma,Alammj,Kimb,et al.Ginsenoside-Rb1 prevents bone cartilage destruction through down-regulation of p-Akt,p-P38,and p-P65 signalinginrabbit[J].Phytomedicine,2022,100:154039.



