代姝媛,王夙琴,张彩妮,谭嘉彦,冯慧琴,李娅*
摘要:目的:探究乌药内酯在非小细胞肺癌(Non-small cell lung cancer,NSCLC)治疗中的潜力及其分子机制。方法:裸鼠接种A549细胞构建皮下成瘤模型,并监测瘤体生长和裸鼠体重变化;随机分组进行溶剂和乌药内酯治疗,结束后取材并测量瘤体重量;采HE染色和IHC染色观察细胞和组织结构以及Ki67蛋白表达;体外实验中使用CCK-8细胞增殖试剂盒和平板克隆形成实验评估细胞增殖能力;流式细胞分析和Annexin-V/PI染色法分析细胞周期和凋亡率,WB检测凋亡相关蛋白表达;细胞划痕和Transwell迁移实验评估细胞迁移和侵袭能力。结果:乌药内酯抑制裸鼠皮下NSCLC肿瘤的生长,降低肿瘤组织中Ki67的表达;剂量依赖性地抑制A549和H1299细胞的增殖、迁移和侵袭能力,阻滞NSCLC细胞周期于G2/M期并诱导其凋亡。结论:乌药内酯可抑制移植瘤小鼠中的癌组织生长同时抑制肺癌细胞生长。
关键词:中药;乌药内酯;非小细胞肺癌
Abstract:Objective:To investigate the potential of udonolactone in the treatment of non-small cell lung cancer(NSCLC)and its molecular mechanism.Methods:Nude mice were inoculated with A549 cells to establish a subcutaneous tumor model,and tumor growth and weight changes of nude mice were monitored;random groups were subjected to solvent and ubiquinolactone treatments,and tumor weights were collected and measured at the end of the treatments;HE staining and IHC staining were performed to observe cell and tissue structures and Ki67 protein expression;in vitro experiments were performed using CCK-8 cell proliferation kit and platelet clonogenic formation assay to evaluate cell proliferation ability;flow cytometric analysis and annexin analysis were used to evaluate cell proliferation ability.In vitro experiments,cell proliferation ability was evaluated by CCK-8 cell proliferation kit and plate clone formation assay;cell cycle and apoptosis rate were analyzed by flow cytometric analysis[基金项目:国家自然科学基金资助项目(82160696)
作者单位:昆明医科大学附属医院检验科(邮编:650000)
*通讯作者E-mail:13708710060 139.com]and Annexin-V/PI staining,and the expression of apoptosis-related proteins was detected by WB;and the migration and invasion ability of cells was evaluated by cell scratch and transwell migration assay.Results:Ubiquitinolide inhibited the growth of subcutaneous NSCLC tumors in nude mice and decreased the expression of Ki67 in tumor tissues;it dose-dependently inhibited the proliferation,migration,and invasive ability of A549 and H1299 cells,and blocked the NSCLC cell cycle in the G2/M phase and induced their apoptosis.Conclusion:Ubiquitinolide can inhibit the growth of cancerous tissues in transplanted tumor-bearing mice as well as inhibit the growth of lung cancer cells.
Keywords:Traditional Chinese medicine;Linderalactone;Non-small cell lung cancer
恶性肿瘤特别是肺癌对患者的身心健康造成严重影响。在全球范围内,肺癌是最常见且致死率极高的恶性肿瘤之一,尤其在60岁以上的人群中更为普遍[1]。尽管现有治疗包括手术、放疗、化疗和靶向治疗[2],但因其发展缓慢和晚期症状,许多患者在确诊时已处于晚期,治疗难度和风险显著增加,且传统治疗方法存在诸多局限性,如手术不适用于晚期患者,放疗和化疗副作用大,靶向治疗仅适用于特定亚型,同时还面临耐药性和复发的挑战[3-5]。
在面对传统治疗方法局限性的挑战下,植物源药物在肿瘤治疗中展现出重要的潜力。乌药作为传统中药备受关注,主要分布于中国南部地区,其根和叶具有显著药用价值[6]。当前对乌药抗肿瘤活性的研究逐渐深入,多种以乌药为主药的中药方被应用于抗肿瘤治疗[7,8]。乌药内酯作为乌药块根中的主要活性成分,因其在多种癌细胞中广泛显示的抗肿瘤作用备受关注[9-13]。然而,现有文献关于乌药内酯抑制肺癌细胞生长的机制尚不充分。因此,本研究以NSCLC细胞株A549和H1299为对象,探讨乌药内酯对NSCLC的抗癌作用。研究旨在揭示乌药内酯可能的分子机制,为其药物研发和NSCLC临床治疗提供依据。
1材料与方法
1.1材料
1.1.1细胞、动物与试剂
人肺癌细胞株A549和H1299购自ATCC。4~5周龄的BALB/c雌性裸鼠(约20克,12只)购自昆明医科大学实验动物部。使用的试剂包括免疫组化染色试剂盒(北京博奥森生物技术有限公司)、Ki-67、Bax、cleaved-Caspase-8和cleaved-Caspase-9抗体(武汉赛维尔生物科技有限公司)、苏木素伊红染色试剂盒(上海碧云天生物技术有限公司)、乌药内酯(上海源叶生物科技有限公司)、Cell Counting Kit-8(武汉伊莱瑞特生物科技有限公司)、细胞周期试剂盒(武汉伊莱瑞特生物科技有限公司)、Annexin V-FITC/PI流式凋亡试剂盒(武汉伊莱瑞特生物科技有限公司)。
1.1.2仪器
CO2恒温培养箱(美国Thermo Fisher scientific);超净工作台(美国Thermo Fisher scientific);酶标仪(美国Thermo Fisher scientific);倒置显微镜(日本Olympus);流式细胞仪(美国Becton,Dickinson and Company);凝胶成像仪(美国Bio-Rad)。
1.2方法
1.2.1裸鼠体内成瘤实验模型的建立
实验方法经昆明医科大学动物伦理委员会批准(KMU 2021-640)。对数生长期的A549细胞用无血清培养基洗涤后用PBS重悬计数。将PBS与Martigel以1:1混合,悬浮5x106个细胞/200μl,接种于裸鼠第三对乳腺皮下。接种后每日观察肿瘤生长。约一周后,若皮下结节直径达到3-4 mm则认为成瘤。成瘤后每三天测量体重和肿瘤直径,用电子游标卡尺测量长径L和短径W,体积计算公式为V=0.5×L×W2。当肿瘤体积达到100 mm3时,随机分为溶剂对照组和乌药内酯组(10 mg/kg)。
1.2.2给药方式及动物标本的获得
乌药内酯及对应溶剂对照按剂量通过腹腔注射给实验动物,隔天给药,持续2周。观察肿瘤生长和转移情况,并隔天测量肿瘤大小。给药结束后,处死实验动物,采集眼球血、剥离肿瘤组织并称重,同时取心、肝、肾等组织。将肿瘤按组别顺序拍照,随后用4%多聚甲醛固定,固定后用石蜡包埋,并用组织切片机将蜡块切成4μm薄片。
1.2.3裸鼠肿瘤、肝、肺、肾等组织的HE染色
切片在65℃烘箱烘干10-20分钟,于二甲苯中脱蜡15分钟。无水乙醇处理5分钟,再用新鲜无水乙醇处理5分钟。85%和75%酒精各洗5分钟,蒸馏水清洗。苏木精染色5分钟,冲洗3分钟。1%盐酸分化几秒,1%氨水返蓝1分钟,流水冲洗。伊红染色20秒,流水漂洗1分钟。依次用70%、80%、90%、95%酒精脱水1分钟,无水乙醇脱水2次各1分钟。二甲苯处理2次各10分钟,中性树脂封片,观察并采集图像。
1.2.4免疫组化
同HE染色一样,脱蜡后切片进行抗原修复,微波加热至沸腾后冷却,低火加热8分钟。PBS清洗三次,每次5分钟。用3%双氧水避光孵育25分钟,再PBS清洗三次,每次5分钟。山羊血清封闭20分钟,添加第一抗体,4°C过夜。PBS清洗三次,每次5分钟,添加第二抗体,室温孵育50分钟。PBS清洗三次,每次5分钟,加入DAB显色液,停止反应后用蒸馏水洗净。苏木素复染3分钟,蒸馏水分化,自来水冲洗。用75%、85%酒精脱水5分钟,无水乙醇两次各5分钟,二甲苯两次各5分钟。中性树胶封片,显微镜观察。
1.2.5 CCK8检测乌药内酯对肿瘤细胞活力的影响
A549和H1299细胞在RPMI1640培养基中培养至80%-90%汇合。用PBS和胰酶传代,制备单细胞悬液,每孔接种4000个细胞于96孔板,设置6个复孔及空白对照。培养24小时后,加入不同浓度乌药内酯(0-1000µM),继续培养24小时和48小时。终止培养后,加入10µL CCK8试剂孵育1小时,测定450 nm处的OD值,计算细胞存活率为:[(实验组OD值-空白组OD值)/(对照组OD值-空白组OD值)]×100%。
1.2.6平板克隆形成实验
消化处理H1299和A549细胞系,随后接种500个细胞于六孔板内,每组设3个复板。培养至细胞贴壁形成小克隆后给药,继续培养24小时。更换新的培养基,持续培养10天,每隔3天更换一次培养基并观察生长状态。当单克隆细胞数超过50个时,结束培养。完成后,用PBS洗涤细胞3次,每孔加入4%多聚甲醛固定30分钟,再次洗涤,加入0.1%结晶紫染液染色20分钟,最后洗涤并拍照记录并计数。
1.2.7划痕实验
每孔接种5x10^5个细胞,培养在含2 mL培养基的六孔板中,直至细胞贴壁生长。当细胞生长密度达到100%时,使用200uL枪头在每个孔的中心线处垂直划十字形划痕,保持宽度一致。去除原有培养基后,用PBS洗涤两次,加入不同浓度的无血清培养基配置的乌药内酯溶液。在显微镜下拍摄并记录0小时的划痕宽度,继续在培养箱中培养24小时后,再次观察并记录24小时的划痕宽度。通过ImageJ软件分析结果,每组实验独立重复三次。
1.2.8 Transwell迁移和Matrigel侵袭实验
从-20°C冰箱取出基质胶,解冻至4°C。预冷器具及PBS。将基质胶与无血清培养基按1:8稀释,涂布于小室底膜,37°C培养箱中凝固1-2小时。消化对数生长期细胞,调整密度至5×10^5/ml。将不同浓度乌药内酯溶液(0µM、400µM、600µM、800µM)各加入24孔板每孔600µL。将小室放入孔内,加入100µL细胞悬液至上室,培养24小时。取出培养板,吸去培养基,PBS冲洗小室2次。加入1 mL 4%多聚甲醛固定30分钟,弃去固定液,染色0.1%结晶紫20分钟。PBS冲洗3次,擦拭未迁移细胞,倒置晾干,拍照并计数。
1.2.9流式检测细胞周期
将无水乙醇预冷至-20°C,RNaseA解冻于4°C。接种1×10^6对数生长期细胞于6孔板,培养24小时。用不同药物浓度处理24小时。消化细胞,离心去上清,用冷PBS洗涤两次,悬浮于1 mL冷PBS中,加入3 mL冷乙醇(最终浓度75%),4°C固定过夜。用PBS洗涤三次,加入100µL RNaseA(100µg/mL)和400µL PI(50µg/mL),在暗处孵育30分钟。轻轻混匀后,使用流式细胞仪检测,并用Flowjo软件分析数据。
1.2.10流式检测细胞凋亡
采集对数生长期的细胞,并在六孔板每孔接种1x10^6个细胞。24小时后对其进行不同浓度的药物处理,每种浓度进行三次重复,并在处理后24小时终止培养。收集细胞后,以800 rpm离心5分钟并去除上清液,用PBS洗涤一次,随后重悬于100µL的Annexin V Binding Buffer中。加入2.5µL的Annexin V-FITC和2.5µL的PI,轻轻混匀后在室温下孵育15-20分钟。加入400µL的Annexin V Binding Buffer后立即进行流式检测,并使用Flowjo软件分析数据。
1.2.11免疫印迹
收集药物处理的细胞,并向培养孔加入80μL的RIPA溶液,裂解35 min,13000 rpm离心15 min,取上清测定蛋白浓度,10%SDS-PAGE分离蛋白样品,转移至PVDF膜,5%脱脂奶粉封闭2 h,洗膜后加入一抗(Bax、cleaved-Caspase-8、cleaved-Caspase-9、β-actin)4℃孵育过夜,取出后洗膜3次,二抗孵育1 h,洗膜后显影并采用Image J分析灰度值。
结果
2.1乌药内酯对A549细胞裸鼠皮下移植瘤生长抑制作用
本研究在A549细胞诱导的小鼠肺癌模型中验证乌药内酯的作用,通过对各实验组的肺癌组织进行大小和重量测定。结果显示乌药内酯(10 mg/kg组)未改变小鼠体重(图1A,P>0.05),但显著抑制了肿瘤生长(图1B),给药10天后两组肿瘤大小有显著差异(P<0.05)。在给药两周后,给药组肿瘤重量显著轻于溶剂对照组(见图1C,1D,P<0.05)。表明乌药内酯能有效抑制裸鼠移植瘤的生长,并显示出较高的安全性。
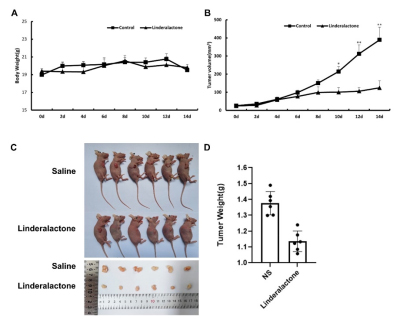
图1乌药内酯治疗对异种移植肿瘤小鼠体重和肿瘤重量及体积的影响
A.各组小鼠体重变化; B.各组小鼠肿瘤体积变化,*P<0.05,**P<0.01;
C.各组移植瘤小鼠肿瘤体积; D.各组移植瘤小鼠肿瘤重量统计图
2.2荷瘤裸鼠的血清生化指标及肿瘤、肺、肝脏、肾脏的HE染色
与溶剂对照组相比,肝功能(ALT、AST、ALP、ALB、TBIL)和肾功能(UREA、CYSc)指标无显著差异(P<0.05),见表1,表明乌药内酯对肝肾功能影响较小。HE染色结果(见图2)显示肺泡、肝小叶和肾小球及肾小管结构正常,无毒性反应。
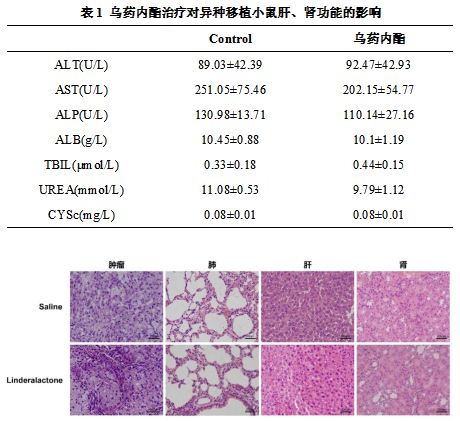
图2乌药内酯治疗对异种移植小鼠肺肿瘤、肺、肝、肾形态的影响
2.3荷瘤裸鼠的肿瘤免疫组化染色
作为肿瘤标志物,Ki67的表达与肿瘤增殖程度呈正相关,为了观察乌药内酯在体内对肺癌肿瘤增殖的作用,检测了肿瘤组织中Ki67的表达情况,结果如图所示,干预两周后,与溶剂对照组相比,乌药内酯给药组肿瘤组织中Ki67的表达均明显降低(图3)。
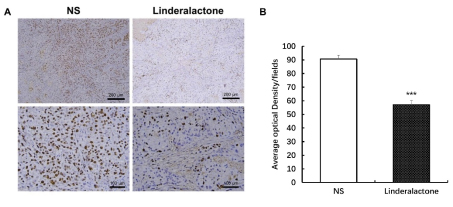
图3乌药内酯治疗对异种移植小鼠肺肿瘤Ki67表达的影响
A.免疫组化Ki67表达示意图;B.Ki67表达的AOD统计,***P<0.001。
2.4乌药内酯有效的抑制了肺癌细胞A549、H1299的存活率
使用CCK-8试剂盒检测乌药内酯对A549和H1299细胞的影响。不同浓度(0-1000μM)处理24小时和48小时后,乌药内酯显著抑制细胞活力,呈剂量依赖。A549细胞24小时和48小时的IC50分别为899.5μM和640μM,H1299细胞为502.4μM和453.5μM(图4)。因此,选择400、600和800μM用于后续实验。
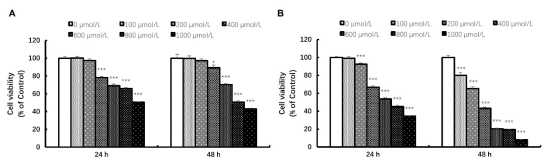
图4乌药内酯处理对肺癌细胞活力的影响
A.乌药内酯A549细胞活力的影响;B.乌药内酯H1299细胞活力的影响,*P<0.05,***P<0.001。
2.5乌药内酯抑制肺癌细胞克隆的形成
乌药内酯处理肺癌细胞24 h继续培养10天结束后,发现与对照组相比,其对细胞的克隆形成有显著的抑制作用,且对H1299单克隆数量形成抑制作用更明显,并呈现良好的剂量关系(见图5),具有统计学意义(P<0.05)。这与细胞CCK-8的实验结果一致,提示乌药内酯具有抑制A549、H1299细胞增殖的作用。
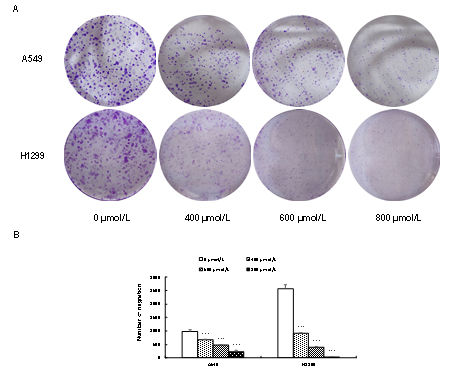
图5乌药内酯处理对A549和H1299细胞增殖率的影响
A.A549和H1299平板克隆测定图;B.A549和H1299平板克隆测定统计,***P<0.001。
2.6乌药内酯对肺癌细胞迁移和侵袭能力的影响
使用400、600和800μM乌药内酯处理细胞24小时,迁移率显著降低(P<0.05),见图6。Transwell迁移实验和侵袭实验显示,细胞穿过PET膜和基质胶的数量均随浓度增加而减少(图7)(P<0.05),表明乌药内酯有效抑制了肺癌细胞的迁移和侵袭。
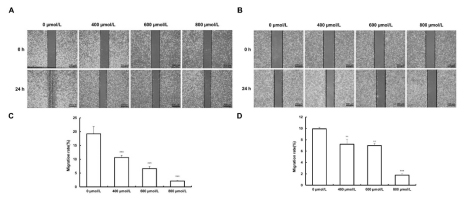
图6乌药内酯处理对肺癌细胞迁移率的影响
A.A549平板划线测定图; B.H1299平板划线测定图;
C.A549平板划线测定统计; D.H1299平板划线测定统计,**P<0.01,***P<0.001。
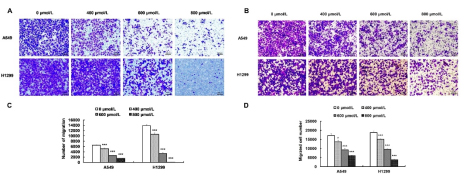
图7乌药内酯处理对肺癌细胞迁移和侵袭能力的影响
A.A549和H1299细胞的Transwell迁移测定; B.A549和H1299细胞的Transwell侵袭测定;
C.A549和H1299细胞的Transwell迁移测定统计; D.A549和H1299细胞的Transwell侵袭测定统计,*P<0.05,***P<0.001。
2.7乌药内酯对细胞周期的影响
乌药内酯(400、600、800µM)处理H1299和A549细胞24小时后,G2/M期百分比显著增加:A549细胞从3.53%升至9.6%、11.5%和13.29%;H1299细胞从0%升至5.69%、19.8%和23.3%(P<0.05)。G1期细胞百分比减少:A549细胞从77.50%降至74.20%、70.14%和57.73%;H1299细胞从50.30%降至50.50%、34.80%和21.43%(P<0.05),400µM组变化不显著(见图8)。
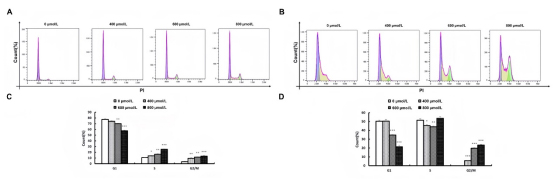
图8乌药内酯处理对肺癌细胞周期的影响
A.流式细胞术检测A549的细胞周期变化;B.流式细胞术检测H1299的细胞周期变化;
C.流式细胞术检测A549的细胞周期变化统计;流式细胞术检测H1299的细胞周期变化统计,*P<0.05,**P<0.01,***P<0.001。
2.8乌药内酯对肺癌细胞凋亡的影响
Annexin V-FITC和PI染色的流式细胞仪分析显示,乌药内酯处理24小时后,A549和H1299细胞的凋亡率随浓度增加而上升。A549细胞的凋亡比例由3.31%增至3.0%、7.3%、18.0%;H1299细胞的凋亡率由2.99%增至2.9%、7.6%、16.1%(400μM组差异不显著,P<0.05,见图9)。WB结果显示,乌药内酯显著上调了Bax、cleaved-Caspase-8和cleaved-Caspase-9的表达(P<0.05,见图10)。这些数据表明乌药内酯能有效诱导肺癌细胞凋亡。

图9乌药内酯处理对肺癌细胞凋亡率的影响
A.流式细胞术检测A549的细胞凋亡变化;B.流式细胞术检测H1299的细胞凋亡变化;
C.流式细胞术检测A549的细胞凋亡变化统计;D.流式细胞术检测H1299的细胞凋亡变化统计,***P<0.001。
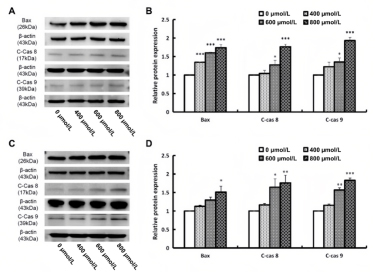
图10乌药内酯处理对A549和H1299细胞凋亡蛋白表达的影响
A.WB检测A549细胞Bax、cleaved-Caspase-8、cleaved-Caspase-9的蛋白表达;
B.WB统计A549细胞Bax、cleaved-Caspase-8、cleaved-Caspase-9的蛋白表达统计;
C.WB检测H1299细胞Bax、cleaved-Caspase-8、cleaved-Caspase-9的蛋白表达;
D.WB统计H1299细胞Bax、cleaved-Caspase-8、cleaved-Caspase-9的蛋白表达统计;*P<0.05,**P<0.01,***P<0.001。
讨论
NSCLC是我国常见且发病率高的肺癌类型。尽管现有化疗药物种类繁多,但耐药性和副作用依然是主要挑战。作为传统医学的一部分,中草药展示了潜在的抗肿瘤效果。乌药内酯作为从乌药提取的天然产物,已显示出对肺癌组织显著的生长抑制作用。本研究观察到,低剂量(25 mg/kg)和高剂量(50 mg/kg)乌药内酯均有效抑制了胰腺癌小鼠的肿瘤生长,其中高剂量效果更为显著。在移植瘤模型中,给予10 mg/kg乌药内酯后,肿瘤生长显著抑制,裸鼠的饮食和活动正常,体重稳定。HE染色显示主要脏器组织结构正常,未见异常病理变化。血清生化检测未发现肝肾功能显著差异,但由于正常值范围不明确和样本量较少,评估可能受个体差异影响。Ki67是评估肿瘤细胞增殖的标志物,高水平通常与肿瘤恶性程度相关[14,15]。实验结果表明,乌药内酯处理组的肿瘤Ki67表达明显降低,显示其有效抑制了NSCLC的增殖。此外,乌药内酯在给药组中未见明显毒副作用,显示了较高的安全性。
本研究还探讨了乌药内酯的作用机制,结果显示其对A549和H1299细胞有显著抑制作用,且效果随浓度增加更为显著。乌药内酯处理导致细胞周期停滞在G2/M期,增加了细胞凋亡率,并提升了Bax、cleaved-Caspase-8和cleaved-Caspase-9的表达。这些结果表明乌药内酯通过调节细胞周期和促进细胞凋亡发挥抗癌作用。Caspase家族蛋白在细胞凋亡调控中起关键作用,乌药内酯可能通过增加这些蛋白的表达来促进细胞凋亡。此外,乌药内酯显著抑制了细胞的侵袭和迁移,与其他研究结果一致[16,17],显示其可能通过抑制肺癌细胞的转移和侵袭来增强抗癌效果。
总的来说,本研究表明乌药内酯对肺癌具有显著疗效,包括调节细胞周期、促进凋亡及抑制侵袭和迁移。但其具体机制尚需进一步研究,以便更好地利用其在肺癌治疗中的潜力。
参考文献
[1]Du J,SunH,Sun Y,Du J,Cao W,Sun S.Assessment of age,period,and cohort effects oflung cancer incidence in Hong Kong and projection up to 2030 based on changingdemographics[J].Am J Cancer Res.2021,11(12):5902-5916.
[2]Herbst RS,Morgensztern D,Boshoff C.The biology and management of non-small cell lung cancer[J].Nature.2018,553(7689):446-454.
[3]Liang J,Gu W,Jin J,Zhang H,Chen Z,Tang Y,Zhang S,Yang S,Deng Y,Feng W.Efficacyand safety of apatinib as third-or further-line therapy for patients withadvanced NSCLC:a retrospective study[J].Ther Adv Med Oncol.2020,12:1758835920968472.
[4]Kelemen O,Pla I,Sanchez A,Rezeli M,Szasz AM,Malm J,Laszlo V,Kwon HJ,Dome B,Marko-Varga G.Proteomic analysisenables distinction of early-versus advanced-stage lung adenocarcinomas[J].Clin Transl Med.2020,10(2):e106.
[5]Duma N,Santana-Davila R,Molina JR.Non-small cell lung cancer:epidemiology,screening,diagnosis,and treatment[J].Mayo Clin Proc.2019,94(8):1623-1640.
[6]求鑫瑜,楼招欢.地理分布与乌药药材品质“道地性”的相关性分析[J].浙江中医药大学学报,2021,45(10):1135-1143.
[7]余炜,魏丞,余辉等.基于网络药理学和分子对接研究“乌药蜜饮”对治疗结直肠癌的作用[J].中国临床药理学杂志,2023,39(23):3486-3490.
[8]陈金红,周洁.暖肝煎联合化疗治疗直肠癌术后患者的临床观察[J].中国中医药现代远程教育,2018,16(10):112-114.
[9]Hwang JY,Park JH,Kim MJ,Kim WJ,Ha KT,Choi BT,Lee SY,Shin HK.Isolinderalactoneregulates the BCL-2/caspase-3/PARP pathway and suppresses tumor growth in ahuman glioblastoma multiforme xenograft mouse model[J].Cancer Lett.2019,443:25-33.
[10]Deng Y,Li Y.Linderalactone inhibitshuman lung cancer growth by modulating the expression of apoptosis-relatedproteins,G2/M cell cycle arrest and inhibition of JAK/STAT signalling pathway[J].J BUON.2019,24(2):566-571.
[11]刘自尧,杨芳,赵崇妍,杨鹏硕,连增林,史新元.异乌药内酯对人乳腺癌MCF-7细胞的生长抑制作用及其机制研究[J].中草药,2019,50(12):2922-2927.
[12]Xu D,TianM,Chen W,Bian Y,Xia X,Liu Q,Zheng L,Zhang X,Shen H.Linderalactonesuppresses pancreatic cancer development in vitro and in vivo via negativelyregulating PI3K/AKT signaling pathway[J].J Oncol.2022,2022:8675096.
[13]Rajina S,Kim WJ,Shim JH,Chun KS,Joo SH,Shin HK,Lee SY,Choi JS.Isolinderalactoneinduces cell death via mitochondrial superoxide-and STAT3-mediated pathways inhuman ovarian cancer cells[J].Int J Mol Sci.2020,21(20):7530.
[14]MitchellKG,Parra ER,Nelson DB,Zhang J,Wistuba II,Fujimoto J,Roth JA,Antonoff MB.Tumor cellular proliferation is associated with enhanced immune checkpointexpression in stage I non-small cell lung cancer[J].J Thorac Cardiovasc Surg.2019,158(3):911-919.e6.
[15]Klöppel G,La Rosa S.Ki67 labeling index:assessment and prognostic role ingastroenteropancreatic neuroendocrine neoplasms[J].Virchows Arch.2018,472(3):341-349.
[16]Chang WA,Lin ES,Tsai MJ,Huang MS,KuoPL.Isolinderalactone inhibits proliferation ofA549 human non‑small cell lung cancer cells by arresting the cell cycle at theG0/G1 phase and inducing a Fas receptor and soluble Fas ligand-mediatedapoptotic pathway[J].MolMed Rep.2014,9(5):1653-1659.
[17]Chuang CH,Wang LY,Wong YM,Lin ES.Anti-metastatic effects of isolinderalactone via the inhibition of MMP-2 and upregulation of NM23-H1 expression in human lung cancer A549 cells[J].Oncol Lett.2018,15(4):4690-4696.



